JUAN I. ROJAS, LILIANA PATTRUCCO, EDGARDO CRISTIANO
Centro de Esclerosis Múltiple de Buenos Aires, Hospital Italiano de Buenos Aires, Argentina
Resumen Durante los últimos años, el desarrollo de medidas de evaluación de la acumulación de la discapacidad y la actividad inflamatoria en las formas progresivas de esclerosis múltiple (EM) ha sido un punto central de investigación de diversos grupos. Se han desarrollado y aplicado distintos instrumentos con el fin de identificar en forma precisa y precoz la actividad y la progresión en este fenotipo de EM. Muchas de esas herramientas, con mayor o menor sensibilidad, han sido utilizadas en ensayos clínicos, aunque su uso en la práctica asistencial no es del todo familiar para los profesionales involucrados en el cuidado de pacientes con EM. El objetivo de esta revisión es describir las medidas de evaluación clínica y por imágenes implementadas durante los últimos años para la identificación de la actividad y evolución de esta enfermedad en sus formas progresivas.
Palabras clave: evaluación clínica, esclerosis múltiple progresiva, evaluación radiológica
Abstract Clinical and radiological outcomes measures in progressive multiple sclerosis. During recent years, the development of measures to assess the accumulation of disability and inflammatory activity in the progressive forms of multiple sclerosis (MS) has been a central point of research in various groups.
Several instruments have been developed and implemented in order to accurately and early identify the activity and progression in this MS phenotype. Many of these tools, with greater or lesser sensitivity, have been used in clinical trials, although their use in healthcare practice is not entirely familiar to professionals involved in the care of patients with MS. The objective of this review is to describe the clinical and imaging evaluation measures implemented during the last years to identify the activity and the evolution of the disease in its progressive forms.
Key words: outcome measures, progressive multiple sclerosis, clinical evaluation, radiological evaluation
Recibido: 4-VI-2018 Aceptado: 1-X-2018
Dirección postal: Dr. Juan Ignacio Rojas, Centro de Esclerosis Múl- tiple de Buenos Aires, Hospital Italiano de Buenos Aires, Ttel. Gral. Juan D. Perón 4190, 1199 Buenos Aires, Argentina
e-mail juan.rojas@hospitalitaliano.org.ar
La esclerosis múltiple (EM) es una enfermedad cró- nica degenerativa de etiología autoinmune que afecta preferentemente adultos jóvenes entre los 18 y 35 años, y constituye la primera causa de discapacidad física de origen no traumático en varios países del mundo1-3.
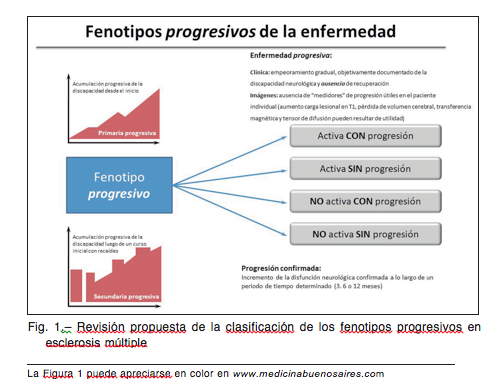
En 1996, un comité de expertos definió en 4 fenotipos el curso clínico de la enfermedad: fenotipo recaída-remi- sión, secundaria progresiva, primaria progresiva y pro- gresiva con recaídas4. En 2013, ese panel de expertos y otros involucrados, reexaminaron los fenotipos, analizaron la evidencia existente e hicieron recomendaciones sobre esos fenotipos centrales (con recaídas y progresivos), la evaluación de la actividad (a través de la presencia de recaídas o nuevas lesiones en resonancia) y cómo evaluar la progresión de la enfermedad en un período determinado (Fig. 1)5.
Durante los últimos años, el desarrollo de medidas de evaluación de la acumulación de discapacidad y de la actividad inflamatoria en las formas progresivas de EM ha sido un punto central de investigación de diversos gru- pos6-9. Se desarrollaron e implementaron variados instru- mentos con el fin de identificar en forma precisa y precoz la actividad y la progresión en este fenotipo7. Muchas de esas herramientas, con mayor o menor sensibilidad, se utilizaron en ensayos clínicos, no siendo del todo familiar su uso en la práctica asistencial para los profesionales involucrados en el cuidado de pacientes con EM.
El objetivo de la siguiente revisión es describir las medidas de evaluación clínicas y por imágenes implementadas durante los últimos años para evaluar la actividad inflama- toria y la acumulación de discapacidad de la enfermedad en las formas progresivas de EM.
Medidas de evaluación clínica
Escala ampliada del estado de discapacidad (Expanded Disability Status Scale, EDSS)
La escala EDSS para medir la discapacidad física y su progresión ha sido usada sistemáticamente en pacien- tes con EM10. Se basa en la combinación de exámenes neurológicos, de la capacidad de deambular y de llevar
adelante actividades de la vida diaria. La puntuación de la escala va de 0 a 10 siendo 0 la ausencia de alteracio- nes y 10 la muerte producida por la enfermedad10. Esta escala tiene la ventaja de ser una de las más conocidas y usadas por los profesionales involucrados en el cuida- do de pacientes con EM, permite medir y comparar los casos entre sí y temporalmente, no lleva mucho tiempo su implementación en la práctica clínica y es una de las escalas solicitadas por los entes regulatorios para evaluar la eficacia de intervenciones en EM11, 12. Si bien su uso está difundido, es importante reconocer que el EDSS tiene varias limitaciones. Una de ellas es que da un peso muy importante al examen físico neurológico, el cual puede ser subjetivo y no siempre bien estandarizado en la práctica asistencial7. Por otro lado, el EDSS mostró variabilidad intra e inter-evaluador, lo que disminuye su confiabilidad, aunque en los EDSS más altos, la variabilidad parece disminuir13. Por otro lado, la importancia que se otorgue a la función de la ambulación puede relegar aspectos importantes de la motricidad en miembros superiores, con un efecto clínico significativo14. El EDSS también es poco sensible para evaluar la cognición y la fatiga14. Otra limitación importante, sobre todo respecto a su uso en ensayos clínicos, es que la definición de progresión ha sido establecida en general como incremento de 0.5 o 1 punto sostenido del EDSS después de 3 a 6 meses7. Se demostró que tal incremento en ese corto período puede deberse a cambios aleatorios y no como consecuencia de una progresión clínica sostenida de la enfermedad, convirtiendo muchas veces esta medida en poco sensible para detectar cambios tempranos7, 11. Se está intentando mejorar esta herramienta para hacerla más sensible y de evaluación precoz, por ejemplo su digitalización para evitar errores e inconsistencias15, el uso de tiempos más prolongados de progresión sostenida de la discapacidad16 y la utilización de mediciones de EDSS que no sean fijas respecto al valor basal, para incrementar en forma más precisa la detección de la progresión de la discapacidad17.
Compuesto funcional en esclerosis múltiple (Multiple sclerosis functional composite, MSFC) Dadas las limitaciones que se presentaban con el uso de EDSS, se desarrolló otra herramienta con el objetivo de mejorar la evaluación clínica y la detección de progresión de la enfermedad18, 19. La evaluación de MSFC cubre tres dominios: la motricidad de miembros superiores, la deam- bulación y la función cognitiva medidas a través del test de los 9 agujeros (9HPT,9-hole peg test), la prueba de 7.5 metros y el test de suma de una serie auditiva (PASAT, Paced Auditory Serial Addition Test), respectivamente (Tabla 1). Tras la aplicación de estas pruebas, se calcula un score promedio (Z-score) de los sub-test, que permite obtener una medida central de evaluación del paciente18. Las ventajas de esta herramienta incluyen principalmente el incremento de la sensibilidad en la medición funcional, la rapidez con que pueden ser realizadas las pruebas por personal capacitado, la objetividad que tienen las escalas, lo que limita la variabilidad inter e intra-observador, y la posibilidad de tener una medida central de evaluación18. Las principales debilidades son: cómo se interpreta esa medida central (Z-score) y cómo ésta se relaciona con los cambios clínicos en el paciente7, 20. Una posible solución propuesta a esta limitante es mantener separados los dominios funcionales evaluados. Sin embargo, ha sido dificultosa la comparación de subdominios entre pacientes o entre los estudios que utilizaron la herramienta7. Otra limitación es la ausencia de una medida de evaluación de

la función visual, así como la posibilidad de presentar un efecto “techo o piso” al aplicar las escalas, dependiendo del grado de discapacidad del paciente. A pesar de estas desventajas, el MSFC parece ser una alternativa al EDSS, ya que tendría más sensibilidad y precisión para detectar progresión de la enfermedad, con buena correlación intra e inter-observador, proveyendo un dato numérico continuo funcional comparable entre pacientes y convirtiendo así al MSFC en una medida de evaluación primaria en futuros ensayos clínicos20.
Otras medidas de evaluación clínica
(test de la marcha)
En algunos ensayos clínicos se aplicaron otras medidas de evaluación orientadas a detectar progresión de la enfermedad. La prueba de 7.5 metros ya fue comentada previamente en la escala combinada de MSFC18. Otra prueba utilizada fue la de los 6 minutos de caminata (6 Minute Walk Test, 6MWT)21 que provee una medida de velocidad de la marcha y resistencia, que se correlaciona con discapacidad y con algunos resultados informados por los pacientes. Tiene una buena correlación inter e intra-evaluador y una medida precisa de cambio e impacto clínico (un cambio del 20% es considerado clínicamente relevante). Si bien la prueba tiene diversas fortalezas, es importante destacar que el riesgo de que el paciente se fatigue, se caiga y la necesidad de espacios amplios para llevarla a cabo, pueden afectar su puesta en práctica21.
Medidas combinadas
Con la intención de incrementar la sensibilidad en la detección de la acumulación de discapacidad en formas progresivas de EM, algunos ensayos clínicos utilizaron medidas combinadas de evaluación11. Un ejemplo de ello se encuentra en el estudio que evaluó la eficacia y seguridad de fingolimod en pacientes con EM primaria progresiva22. En dicho estudio se usó como medida de resultado primario al cambio sostenido a los 3 meses res- pecto al basal, de cualquiera de las siguientes medidas: incremento del EDSS en 1 punto para el EDSS basal < 5, o de 0.5 para EDSS basal ≥ 5.5; incremento del tiempo de la prueba de 7.5 metros en ≥ 20%, o un incremento ≥ 20% en el tiempo de la prueba de los 9 agujeros (9HPT)22. Esta medida combinada mostró en el estudio una sensibilidad del 80% para detectar el cambio. Por otro lado, en el estu- dio que evaluó la eficacia de ocrelizumab en EM primaria progresiva, también se utilizó una medida combinada como resultado. Esta medida fue denominada como “no evidencia de progresión o enfermedad activa” (NEPAD, del inglés no evidence of progression or active disease) definida como la evidencia de no progresión del EDSS sostenida en 3 meses, el no incremento del tiempo de la prueba de 7.5 metros en ≥ 20%, el no incremento del tiempo en la prueba de 9HPT en ≥ 20%, la ausencia de nuevas lesiones en la resonancia magnética (RM) en la secuencia T2 o T1 con contraste y la ausencia de recaí- das clínicas23. Esta medida permitió identificar de forma precisa al grupo de pacientes que no había tenido activi- dad clínica y radiológica, así como tampoco progresión de la enfermedad23. Si bien estas medidas combinadas incrementarían la sensibilidad para detectar progresión y actividad, aún resta definir con precisión cuál sería la com- binación de medidas y cuál es la relevancia que se dará a la hora de trasladar datos globales al caso individual.
Progresión de la discapacidad independiente de recaídas y progresión de la discapacidad relacionada a recaídas
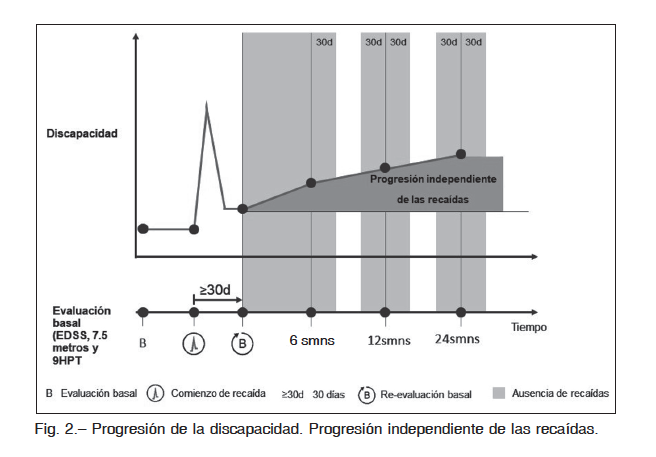
Como mencionamos antes, la reclasificación de los fenotipos mantuvo lo central del fenotipo recaídas y progresivos, pero enfatizó la importancia de identificar la actividad tanto clínica como radiológica. Esto se funda- mentó en la evidencia acumulada durante los últimos años combinado de progresión de la discapacidad (incremento del EDSS, ≥ 20% del tiempo de marcha de 7.5 metros y ≥ 20% de la prueba de 9HPT) que se produjeran sobre el score basal del paciente (separado en al menos 30 días de una recaída, si la hubiere), y en quienes no se obser- varan recaídas por al menos 30 días posteriores de haber comenzado con la progresión de la discapacidad (Fig. 2). Bajo esta forma de evaluar se incrementó la sensibilidad en la identificación de progresión de la discapacidad independiente de recaídas.
Respecto a la progresión de la discapacidad relacionada a recaídas, lo que busca esta medida es evaluar la progresión secundaria a la no recuperación completa post recaída. El estudio que evaluó la eficacia y seguridad de interferón pegilado en EM, propuso definir esta medida como la progresión de la discapacidad que se observó dentro de los 180 días de haber tenido el paciente una respecto a la relevancia que tienen las recaídas sobre la recaída 24. Se propuso que este período de 180 días sea acumulación de discapacidad, la eficacia de los medica- mentos actuales sobre el componente de recaídas y la importancia de evaluar la progresión de la discapacidad independiente y asociada de las recaídas como medida de resultado a la hora de determinar la eficacia de los medicamentos. El objetivo de evaluar la progresión de la discapacidad independiente de las recaídas (PIRA, del inglés progression independet relapse activity) consiste en determinar la progresión sin que dicha determinación sea confundida por el efecto residual de las recaídas clínicas. Recientemente Kappos y col.17, utilizaron esta medida para evaluar la eficacia de intervenciones en pacientes con EM. La definición utilizada para medir este resultado consistió en las modificaciones significativas del score modificado a 90 días para incrementar la sensibilidad de la medición7.
Si bien estas medidas podrían arrojar más claridad en la práctica clínica respecto a progresión independiente o asociada a recaídas, se necesita una más completa validación para su uso.
Medidas de evaluación radiológicas
Carga y volumen lesional en resonancia magnética
Esta medida ha sido ampliamente usada en los últimos años tanto en ensayos clínicos como en la práctica clínica diaria. Incluye principalmente la aparición de nuevas lesiones o agrandamiento de lesiones previas en la secuencia T2 de RM o la aparición de nuevas lesiones que realzan con el contraste, así como a medición del volumen de la carga lesional25. Es una de las más precisas y sensibles de actividad de la en- fermedad en fenotipos recaídas, pero puede no serlo en fenotipo progresivo8. Esto se debe principalmente a que la aparición de nuevas lesiones es menos pro- bable de lo que ocurre en los fenotipos con recaídas8,
- También es importante destacar que la presencia de más o menos lesiones en el estado clínico del pa- ciente es incierto dada la predominancia del fenómeno neurodegenerativo como causal en gran parte de la acumulación de síntomas que se van experimentando26. Si bien la medición de la carga lesional por resonancia es una medida de evaluación que seguirá siendo útil, un refinamiento de la técnica (incremento del campo magnético para mejorar la visualización de lesiones, el uso de contrastes con mayor sensibilidad o la iden- tificación de realce lepto-meníngeo) deberá aplicarse para incrementar la sensibilidad en la detección de la actividad y su impacto en la clínica8, 27.
Medición de atrofia global y regional
La medición de atrofia cerebral como evaluación del fenómeno neurodegenerativo que ocurre de forma pre- coz en EM, ha sido ampliamente correlacionada con la discapacidad física y cognitiva a mediano y largo plazo, así como con mayor actividad de la enfermedad28-30. En la actualidad, la mayor comprensión del fenómeno, y la aparición de técnicas automatizadas y precisas, ha convertido también a esta medida en una herramienta importante en la evaluación de la eficacia de medica- mentos para el control y tratamiento de la EM29. De esta forma, la atrofia cerebral global ha sido aplicada como medida de resultado secundario y primario en diversos ensayos clínicos tanto en pacientes con fe- notipo recaídas como progresivos de EM8, 22, 23, 31-35. La medición de atrofia regional ha sido menos utilizada, pero podría proveer datos más sensibles de progresión de la enfermedad. Entre estas medidas destacamos aquellas que evaluaron la reducción del tálamo, de los nervios ópticos o del núcleo caudado como medidas de resultado secundario, pero con menos difusión de su uso respecto a la atrofia global28, 36. Entre las fortalezas de estas técnicas cabe destacar la alta sensibilidad al cambio que presentan y su reproducibilidad37. Sin embargo, varias limitaciones deben ser superadas aún para su implementación en la práctica, tales como la posibilidad de que factores biológicos confundan la medición, artificios de la imagen, falta de estandariza- ción de los protocolos y el traslado de datos globales a niveles individuales, principalmente8, 38.
Tomografía de coherencia óptica
La tomografía de coherencia óptica (OCT, del inglés optic coherence tomography), es una técnica no invasiva que provee datos de la resolución espacial de la retina, midiendo el grosor de la capa de nervios de la retina y el volumen macular8. El adelgazamiento de la capa de la retina podría traducir el fenómeno degenerativo a nivel del sistema nervioso central en pacientes con EM39. El uso de OCT ha sido incorporado en varios ensayos clínicos en EM progresivas en los últimos años, buscando evaluar el efecto neuroprotector de diversas intervenciones. Si bien su uso se incrementó en los últimos años, no ha sido validada aún como medida de progresión de la enfermedad y su signi- ficado clínico todavía no se ha determinado totalmente8.
Otras técnicas de imágenes
La atrofia de la médula espinal ha sido correlacionada durante los últimos años con una mayor discapacidad física en formas progresiva de EM22, 40, 41. Unos pocos ensayos clínicos han incorporado la medición de la atrofia como medida de evaluación ya que, si bien aportarían un dato preciso y de interés del fenómeno degenerativo, su reproducibilidad y sensibilidad al cambio, al medir estructuras tan pequeñas como la médula, se dificulta considerablemente. También es importante destacar que en la práctica clínica existe gran variabilidad a la hora de obtener las secuencias de la médula y, la posibilidad de artificios o errores de medición es significativamente ma- yor comparada con los protocolos de evaluación cerebral.
La tomografía por emisión de positrones (PET), la técnica de transferencia de magnetización, la resonancia magnética funcional, el tensor de difusión y la espectros- copia también han sido aplicadas en algunos ensayos clínicos, pero sus resultados e interpretaciones no han arrojado valores sensibles y reproducibles que hayan permitido la difusión de su empleo en la actualidad8.
Discusión
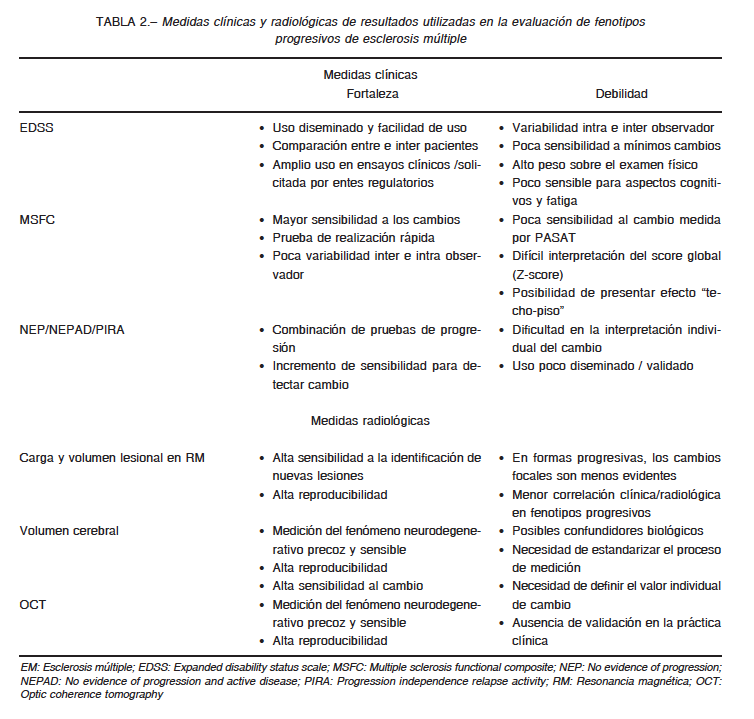
Durante los últimos años se produjeron grandes avances en la comprensión de la frecuencia de la enfermedad en nuestro país y en la medición del componente degenerativo respon- sable de la progresión de la discapacidad en pacientes con EM6, 7, 42, 43. Diversos medicamentos, tales como los interfe- rones, fingolimod, ocrelizumab y rituximab entre otros han sido evaluados a través de estudios que han perfeccionado los criterios utilizados para incluir pacientes, así como para evaluar resultados6,44. Sin embargo, aún queda por definir la mejor manera de evaluar la progresión de la enfermedad de forma precisa y precoz, tanto en el contexto de los estudios clínicos como en la práctica asistencial (Tabla 2).
Futuros estudios que incorporen datos radiológicos, clínicos, cognitivos y otros provenientes de los pacientes, permitirán incrementar la sensibilidad en la detección temprana de la progresión de la enfermedad en EM que facilite el cuidado y el tratamiento de las personas afectadas.
Agradecimiento: Los autores quieren agradecer al depar- tamento médico de Argentina del Laboratorio Roche por el apoyo irrestricto para llevar adelante el trabajo de investigación.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Ebers GC. Environmental factors and multiple sclerosis. Lancet Neurol 2008; 7: 268-77.
2. Montalban X, Tintore M. Multiple sclerosis in 2013: novel triggers, treatment targets and brain atrophy measures. Nat Rev Neurol 2014; 10: 72-3.
3. Noseworthy JH, Lucchinetti C, Rodriguez M, Weinshenker
BG. Multiple sclerosis. N Engl J Med 2000; 343: 938-52.
4. Lublin FD, Reingold SC. Defining the clinical course of mul- tiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. Neurology 1996; 46: 907-11.
5. Lublin FD, Reingold SC, Cohen JA, et al. Defining the clinical course of multiple sclerosis: the 2013 revisions. Neurology 2014; 83: 278-86.
6. Ontaneda D, Thompson AJ, Fox RJ, Cohen JA. Progressive multiple sclerosis: prospects for disease therapy, repair, and restoration of function. Lancet 2017; 389: 1357-66.
7. Ontaneda D, Cohen JA, Amato MP. Clinical outcome measures for progressive MS trials. Mult Scler 2017; 23: 1627-35.
8. Moccia M, de Stefano N, Barkhof F. Imaging outcome measures for progressive multiple sclerosis trials. Mult Scler 2017; 23: 1614-26.
9. Rojas JI, Romano M, Patrucco L, Cristiano E. A systematic review about the epidemiology of primary progressive multiple sclerosis in Latin America and the Caribbean. Mult Scler Relat Disord 2018; 22: 1-7.
10. Kurtzke JF. Rating neurologic impairment in multiple sclerosis: an expanded disability status scale (EDSS). Neurol- ogy 1983; 33: 1444-52.
11. Cohen JA, Reingold SC, Polman CH, Wolinsky JS, Interna- tional Advisory Committee on Clinical Trials in Multiple S. Disability outcome measures in multiple sclerosis clinical trials: current status and future prospects. Lancet Neurol 2012; 11: 467-76.
12. Hobart J, Freeman J, Thompson A. Kurtzke scales revis- ited: the application of psychometric methods to clinical intuition. Brain 2000; 123 ( Pt 5): 1027-40.
13. Goodkin DE, Cookfair D, Wende K, et al. Inter- and intrarater scoring agreement using grades 1.0 to 3.5 of the Kurtzke Expanded Disability Status Scale (EDSS). Mul- tiple Sclerosis Collaborative Research Group. Neurology 1992; 42: 859-63.
14. Brissart H, Sauvee M, Latarche C, Dillier C, Debouverie M. Integration of cognitive impairment in the expanded dis- ability status scale of 215 patients with multiple sclerosis. Eur Neurol 2010; 64: 345-50.
15. Kappos L, D’Souza M, Lechner-Scott J, Lienert C. On the origin of Neurostatus. Mult Scler Relat Disord 2015; 4: 182-5.
16. Signori A, Izquierdo G, Lugaresi A, et al. Long-term dis- ability trajectories in primary progressive MS patients: A latent class growth analysis. Mult Scler 2018;24: 642-52.
17. Kappos L, Butzkueven H, Wiendl H, et al. Greater sensitivity to multiple sclerosis disability worsening and pro- gression events using a roving versus a fixed reference value in a prospective cohort study. Mult Scler 2018; 24: 963-73.
18. Fischer JS, Rudick RA, Cutter GR, Reingold SC. The Mul- tiple Sclerosis Functional Composite Measure (MSFC): an integrated approach to MS clinical outcome assessment. National MS Society Clinical Outcomes Assessment Task Force. Mult Scler 1999; 5: 244-50.
19. Rudick R, Antel J, Confavreux C, et al. Recommendations from the National Multiple Sclerosis Society Clinical Out- comes Assessment Task Force. Ann Neurol 1997; 42: 379-82.
20. Ontaneda D, LaRocca N, Coetzee T, Rudick R, Force NMT. Revisiting the multiple sclerosis functional composite: proceedings from the National Multiple Sclerosis Society (NMSS) Task Force on Clinical Disability Measures. Mult Scler 2012; 18: 1074-80.
21. Goldman MD, Marrie RA, Cohen JA. Evaluation of the six-minute walk in multiple sclerosis subjects and healthy controls. Mult Scler 2008; 14: 383-90.
22. Lublin F, Miller DH, Freedman MS, et al. Oral fingolimod in primary progressive multiple sclerosis (INFORMS): a phase 3, randomised, double-blind, placebo-controlled trial. Lancet 2016; 387: 1075-84.
23. Montalban X, Hauser SL, Kappos L, et al. Ocrelizumab versus Placebo in Primary Progressive Multiple Sclerosis. N Engl J Med 2017; 376: 209-20.
24. Newsome SD, Kieseier BC, Liu S, et al. Peginterferon beta 1a reduces disability worsening in relapsing-remitting multiple sclerosis: 2-year results from ADVANCE. Ther Adv Neurol Disord 2017; 10: 41-50.
25. Sormani MP, Bruzzi P. MRI lesions as a surrogate forrelapses in multiple sclerosis: a meta-analysis of randomised trials. Lancet Neurol 2013; 12: 669-76.
26. Khaleeli Z, Ciccarelli O, Mizskiel K, et al. Lesion enhance- ment diminishes with time in primary progressive multiple sclerosis. Mult Scler 2010; 16: 317-24.
27. Zivadinov R, Ramasamy DP, Hagemeier J, et al. Evaluation of leptomeningeal contrast enhancement using pre-and postcontrast subtraction 3D-FLAIR imaging in multiple sclerosis. AJNR Am J Neuroradiol 2018.
28. Popescu V, Agosta F, Hulst HE, et al. Brain atrophy and lesion load predict long term disability in multiple sclerosis. J Neurol Neurosurg Psychiatry 2013; 84: 1082-91.
29. Kappos L, De Stefano N, Freedman MS, et al. Inclusion of brain volume loss in a revised measure of ‘no evidence of disease activity’ (NEDA-4) in relapsing-remitting multiple sclerosis. Mult Scler 2016; 22: 1297-305.
30. Sormani MP, Arnold DL, De Stefano N. Treatment effect on brain atrophy correlates with treatment effect on disability in multiple sclerosis. Ann Neurol 2014; 75: 43-9.
31. Hawker K, O’Connor P, Freedman MS, et al. Rituximab in patients with primary progressive multiple sclerosis: results of a randomized double-blind placebo-controlled multicenter trial. Ann Neurol 2009; 66: 460-71.
32. Cohen JA, Coles AJ, Arnold DL, et al. Alemtuzumab versus interferon beta 1a as first-line treatment for patients with relapsing-remitting multiple sclerosis: a randomised controlled phase 3 trial. Lancet 2012; 380: 1819-28.
33. Cohen JA, Barkhof F, Comi G, et al. Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. N Engl J Med 2010; 362: 402-15.
34. Confavreux C, O’Connor P, Comi G, et al. Oral terifluno mide for patients with relapsing multiple sclerosis (TOW- ER): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Neurol 2014; 13: 247-56.
35. Kappos L, Radue EW, O’Connor P, et al. A placebo- controlled trial of oral fingolimod in relapsing multiple sclerosis. N Engl J Med 2010; 362: 387-401.
36. Jasperse B, Vrenken H, Sanz-Arigita E, et al. Regional brain atrophy development is related to specific aspects of clinical dysfunction in multiple sclerosis. Neuroimage 2007; 38: 529-37.
37. Zivadinov R, Sepcic J, Nasuelli D, et al. A longitudinal study of brain atrophy and cognitive disturbances in the early phase of relapsing-remitting multiple sclerosis. J Neurol Neurosurg Psychiatry 2001; 70: 773-80.
38. Rojas JI, Patrucco L, Besada C, Bengolea L, Cristiano E. Brain atrophy at onset and physical disability in multiple sclerosis. Arq Neuropsiquiatr 2012; 70: 765-8.
39. Herrero R, Garcia-Martin E, Almarcegui C, et al. Progres- sive degeneration of the retinal nerve fiber layer in pa- tients with multiple sclerosis. Invest Ophthalmol Vis Sci2012; 53: 8344-9.
40. Gass A, Rocca MA, Agosta F, et al. MRI monitoring of pathological changes in the spinal cord in patients with multiple sclerosis. Lancet Neurol 2015; 14: 443-54.
41. Montalban X, Sastre-Garriga J, Tintore M, et al. A single- center, randomized, double-blind, placebo-controlled study of interferon beta-1b on primary progressive and transi- tional multiple sclerosis. Mult Scler 2009; 15: 1195-205.
42. Rojas JI, Patrucco L, Cristiano E. Esclerosis múltiple en la Argentina. Revisión sistemáticica y meta-análisis. Medicina (B Aires) 2012; 72: 449-54.
43. Quintana FJ, Pérez-Sánchez S, Farez MF. Inmunopatología de la esclerosis múltiple. Medicina (B Aires) 2014; 74: 404-10.
44. Fox RJ, Chataway J. Advancing trial design in progressive multiple sclerosis. Mult Scler 2017; 23: 1573-8.
