EDGARD ANDRADE1, ZAKIR SHAIKH2, WILSON CHAVEZ3, ALCY TORRES4
1Instituto de Neurociencias Pediátrico, Ocala, Florida, USA, 2Instituto Municipal de Educación e Investigaciones Médicas Surat, Gujarat, India, 3Facultad de Ciencias Médicas, Universidad de Guayaquil, Guayaquil, Ecuador, 4Departamento de Pediatría, División de Neurología, Boston University, Boston, MA, USA
Resumen Las convulsiones neonatales están entre las manifestaciones más dramáticas de enfermedad
neurológica y deben ser consideradas una emergencia. La incidencia es 3.5 por cada 100 nacidos a término y en prematuros asciende a 58 por cada 100 nacidos vivos. Las convulsiones neonatales son una manifestación clínica de disfunción cortical no específica que puede dar lugar a daño permanente del cerebro. La etiología es multifactorial y requiere una evaluación cuidadosa de cada escenario clínico. El diagnóstico es más complejo por el hecho de que la mayoría de convulsiones son sub-clínicas o sutiles y a veces no tienen correlación con el electroencefalograma. Aunque la identificación temprana y el tratamiento son críticos, el diagnóstico se complica por algunos factores como la variedad de presentaciones clínicas, diferentes etiologías y varias alternativas de tratamiento. De todas maneras, los estudios de investigación y la evidencia clínica disponible han demostrado que el tratamiento precoz con fármacos anticonvulsivantes puede mejorar el pronóstico.
Palabras clave: convulsiones, neonatales, tratamiento, fenobarbital, fenitoína, levetiracetam
Abstract Treatment of neonatal seizures. Neonatal seizures are among the most dramatic manifestations
of acute central nervous system dysfunction. The incidence is much higher in very low weight neonates than in full term infants (~58 and 3.5 per 100 live births, respectively). Neonatal seizures represent the clinical manifestation of a non-specific cortical cerebral dysfunction which can lead to permanent brain injury. The etiology is multifactorial and requires a judicious assessment for each clinical scenario. The diagnosis is further complicated by the fact that most neonatal seizures are subclinical, that is, may display very subtle or no clinical changes and the diagnosis may just be based on EEG findings. The treatment depends on the etiology, but an early and opportune intervention prevents further brain damage, thus improving prognosis. Although early identification and treatment are critical, the diagnosis of neonatal seizures is complicated by several factors such as different clinical presentations, possible etiologies and several treatment options. Nevertheless, research studies and clinical evidence have shown that early treatment with anti-seizure medications can change the outcome.
Key words: neonatal, seizures, treatment, phenobarbital, phenytoin, levetiracetam
e-mail: artorres@bu.edu
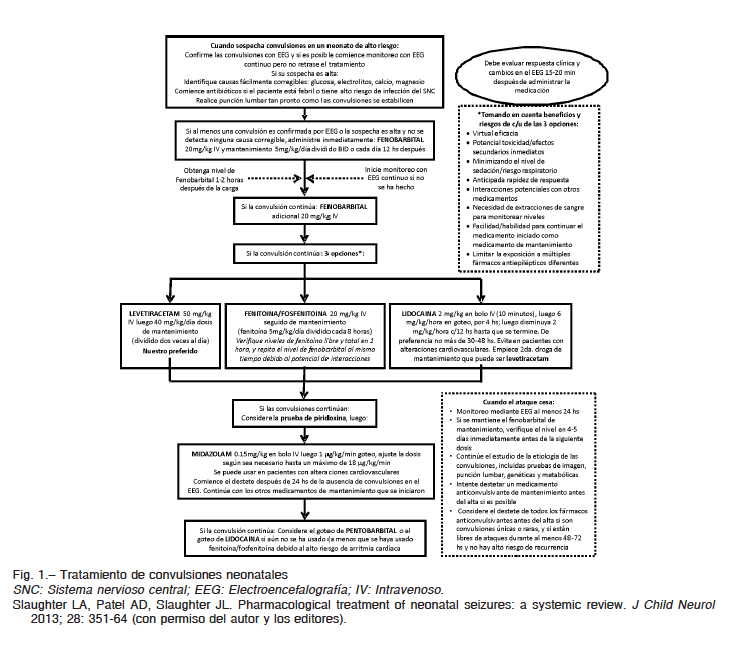
Al tratar un neonato por convulsiones no se deben escatimar esfuerzos para llegar a un diagnóstico correcto sin que esto signifique demorar el tratamiento en todo paciente en quien la sospecha clínica sea razonable. El examen más importante es el video-electroencefalograma si está disponible. Las convulsiones deben ser tratadas debido al posible compromiso de la función respiratoria, circulatoria, metabólica y del desarrollo cerebral1. El objetivo de la terapia es eliminar las convulsiones clínicas y luego las electrográficas de ser posible. La terapia anticonvulsiva puede dar lugar a un fenómeno de disociación electromecánica en el cual las convulsiones clínicas cesan pero los fenómenos eléctricos permanecen2.
El fenobarbital es el agente de elección de primera línea para el tratamiento de convulsiones neonatales seguido por fosfenitoína y levetiracetam. Otras opciones son lorazepam, midazolam, topiramato, lidocaína o suplementos de glucosa, calcio, magnesio, piridoxina, ácido folínico u otros compuestos metabólicos si están deficientes. Debido al posible compromiso de la función respiratoria, el equipo necesario para soporte ventilatorio debe estar disponible inmediatamente2.
Glucosa
Si el infante está hipoglucémico y tiene convulsiones, está indicado prescribir dextrosa al 10% a una dosis de carga de 2 ml/kg y una dosis de mantenimiento de 0.5 gramos/kg/hora. Se puede administrar un segundo bolo si las convulsiones persisten3.
Calcio y magnesio
En neonatos con convulsiones hipocalcémicas se recomienda gluconato de calcio al 5% por vía intravenosa a una dosis de 200 mg/kg. Si también existe hipomagnesemia, se recomienda usar una solución al 50% de sulfato de magnesio intramuscular en una dosis de 0.2 ml/kg. El uso concomitante de calcio y magnesio es recomendado ya que la administración de calcio puede poner en evidencia una hipomagnesemia no diagnosticada y producir más convulsiones. Así mismo, la administración de magnesio ha demostrado corregir la hipocalcemia y la hipomagnesemia. Sin embargo, el magnesio puede producir bloqueo neuromuscular y debilidad transitoria. Dosis diarias de mantenimiento de calcio y magnesio deben ser usados solamente si es necesario1.
Agentes anticonvulsivantes
Fenobarbital
La dosis usual de carga es de 20 mg/kg, administrado por bolo intravenoso; sin embargo la función respiratoria debe de ser monitoreada cuidadosamente. El peso o la edad gestacional no parecen afectar la relación dosis/nivel sérico. Sin embargo, prematuros menores de 30 semanas pueden necesitar dosis más bajas para alcanzar el mismo nivel sanguíneo. Si la dosis inicial no es exitosa pueden ser recomendados bolos adicionales de 10 mg/kg cada uno y en algunos casos son necesarias dosis altas de hasta 65 mg/kg/día en total. Dosis medias de 40 mg/kg han demostrado un buen control convulsivo en el 70% de los casos. La presencia de convulsiones electrográficas y un umbral electrográfico anormal predicen una posible falta de respuesta al fenobarbital. El monitoreo electroencefalográfico continuo es imperativo, aun con un exitoso control convulsivo. El fenobarbital entra rápidamente al sistema nervioso central y su nivel sérico es fácilmente predecible usando la dosis administrada (uno por uno). La proporción del fármaco ligada a proteína es baja y los niveles libres son relativamente más elevados. Otros agentes con propiedades agonistas sobre el receptor GABA, como las benzodiacepinas deben ser considerados. Asimismo, inhibidores del transportador NKCC1 como la bumetanida pueden suprimir la actividad epileptiforme. Esta medicina se usa como diurético en el recién nacido y su uso concomitante con fenobarbital ha sido postulado como un ejemplo de acción sinergista anticonvulsivante4.
Fenitoína y fosfenitoína
Estos fármacos son usualmente considerados en casos de neonatos gravemente asfixiados y con convulsiones pobremente controladas a dosis terapéuticas de fenobarbital de hasta 40 mg/kg. La dosis de carga recomendada de fenitoína es 20 mg/kg o 20 equivalentes de fenitoína/kg para la fosfenitoína. Aproximadamente, 15% de los neonatos que no responden a 40 mg/kg de fenobarbital, pueden responder a fenitoína. Algunos estudios han demostrados una respuesta de hasta el 45% cuando la fenitoína se ha usado como agente de primera línea. La dosis debe ser administrada a una velocidad de 1 mg/kg por minuto para evitar disfunción cardíaca. Así mismo, el neonato debe recibir monitoreo cardiovascular durante su administración. La medicina debe ser administrada directamente por vía venosa y evitar la mezcla con glucosa pues puede precipitar. La dosis del fármaco es seguida de una dosis de solución salina normal. El pH es 12 y su extravasación puede causar daño de los tejidos blandos por lo que es preferible usar fosfenitoína5.
La fosfenitoína es el éster de la fenitoína, tiene mayor solubilidad y pH neutro, lo cual lo hace seguro para administración intravenosa y administración más rápida. La fosfenitoína es dosificada en equivalentes de fenitoína: 1.5 mg de fosfenitoína equivale aproximadamente a 1 mg de fenitoína. La fosfenitoína es convertida a fenitoína por medio de la fosfatasa plasmática y tiene menores riesgos. La fenitoína tiene alta afinidad por las proteínas y por ese motivo resulta más difícil alcanzar niveles terapéuticos en sangre de neonatos con enfermedad renal o hepática. La dosis de mantenimiento es 5 mg/kg/día dividido tres veces6, 7.
Los bloqueadores de canales de sodio (especialmente fenitoína a dosis altas) son una terapia eficaz en encefalopatías epilépticas tempranas causada por mutaciones en SCN2A. Estos fármacos probablemente contrarrestan el aumento de la función del canal de sodio causado por la mutación8, 9.
Benzodiacepinas
– Lorazepam. La droga entra al sistema nervioso central rápidamente y produce efecto anticonvulsivante en menos de 5 minutos. Sin embargo, no se redistribuye tan rápidamente como el diazepam porque es menos lipofílica. El lorazepam inicia su acción a los 2-3 minutos de administrado y su acción dura 6 a 24 horas. El riesgo de depresión respiratoria e hipotensión es menor que con otras benzodiacepinas. La dosis es 0.05-0.10 mg/kg y es administrada por vía intravenosa. La vida media en el neonato asfixiado es de 40 horas debido a la actividad de glucoronidación hepática10.
– Diazepam. Es un anticonvulsivante efectivo pero poco usado debido a su eliminación rápida y a que puede causar colapso cardiovascular o depresión respiratoria grave cuando se lo administra concomitantemente con fenobarbital. La dosis terapéutica es variable y dosis de 0.30 mg/kg han llevado al colapso respiratorio. Adicionalmente, el benzoato de sodio, vehículo acompañante, puede aumentar el riesgo de kernícterus. La medicina se puede usar como infusión intravenosa continua y la dosis recomendada en ese caso es 0.3 mg/kg/hora11.
– Midazolam. En neonatos se usa para tratar convulsiones neonatales refractarias. La dosis de carga es 0.05 a 0.2 mg/kg y la infusión de mantenimiento es 0.05 a 0.1 mg/kg/hora. La dosis puede ser aumentada a 0.05-0.1 mg/kg/hora para un mejor control convulsivo12.
Lidocaína
El mecanismo de acción es desconocido pero se usa como tercera opción para el tartamiento de convulsiones neonatales refractarias. La dosis inicial es 2 mg/kg/hora en 10 minutos seguido de 6 mg/kg/hora por 4 horas para luego disminuir 2 mg/kg/hora cada 12 horas has terminar o 50% menos cada 12 horas. La respuesta es del 70% al 92%. Sin embargo, debido a su riesgo acumulativo, debe ser suspendido en 30-48 horas y la dosis debe ser reducida en prematuros o en recién nacidos con hipotermia terapéutica. La lidocaína puede causar arritmias y se recomienda que los pacientes estén en monitor cardíaco. Se pueden determinar niveles séricos seriados pero se debe chequear el tiempo que el laboratorio requiere para procesarlo. Para nosotros el proceso toma dos días y por lo tanto no es práctico. El umbral tóxico para efectos cardiovasculares es 9 mg/l13.
Levetiracetam
En muchos centros, levetiracetam es usada hoy en día como primera o segunda droga de elección para convulsiones neonatales. Su mecanismo de acción está ligado a la prevención de actividad de los neurotransmisores excitatorios gracias a un sinergismo con la proteína vesicular pre-sináptica SV2a. Es una medicina bastante segura y con pocos efectos secundarios. La dosis óptima no se conoce pero en nuestro centro es común empezar con un bolo de 20-30 mg/kg, aunque la literatura refiere dosis de hasta 50 mg/kg que se puede escalar hasta 80-100 mg/kg dependiendo de la respuesta al tratamiento. La dosis de mantenimiento es 40-100 mg/kg/día dividido en dos o tres veces14 (Fig. 1).
Topiramato
Es un bloqueador del receptor AMPA y tiene efectos anticonvulsivantes. Aunque ha demostrado algunos beneficios, no está disponible en solución intravenosa para tratamiento agudo15.
Otros tratamientos
Otros medicamentos como primidona, tiopental, paraldehído, ácido valproico, carbamazepina han sido propuestos como tratamientos efectivos de convulsiones neonatales, pero su uso es limitado debido a sus efectos adversos y su indisponibilidad intravenosa. Otros tratamientos para adultos como oxcarbacepina, lamotrigina, felbamato y vigabatrina han sido utilizados pero no pueden ser administrados por vía parenteral por lo que se dificulta su empleo en el paciente crítico neonatal16.
Tratamientos de trastornos metabólicos
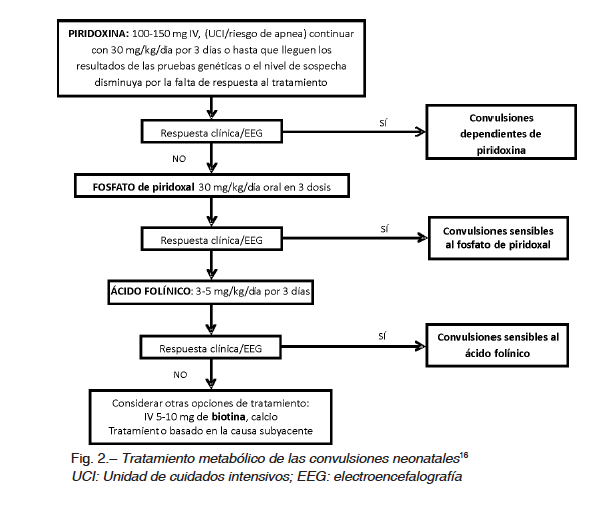
Las convulsiones neonatales refractarias sin una causa específica deben sugerir la posibilidad de convulsiones por dependencia de la piridoxina. Una dosis de infusión intravenosa de 100-150 mg de piridoxina es recomendada. El paciente debe tener monitoreo electroencefalográfico y el procedimiento debe ser realizado en la unidad de cuidados intensivos neonatales por el riesgo de apnea. Si no hay respuesta terapéutica clara en el electroencefalograma se pueden usar bolos adicionales de 100 mg en infusión intravenosa hasta un máximo de 500 mg. Alternativamente, se pueden usar hasta 15-30 mg/kg/día de piridoxina oral. La terapia debe ser mantenida hasta que se descarte la deficiencia de aldehido deshidrogenasa. Algunos neonatos pueden necesitar piridoxal-5-fosfato y la dosis recomendada es 50-100 mg/kg dividido seis veces al día, por al menos 3-5 días. La deficiencia de piridoxina congénita es una aciduria orgánica y debe ser tratada con una dieta restringida en lisina para evitar los efectos nocivos de la acumulación de este aminoácido. Neonatos con convulsiones con respuesta al ácido folínico deben ser tratados con ácido folínico 3-5 mg/kg/día2. Si la causa es una falla de absorción entonces el tratamiento debe ser administrado por vía intramuscular dividido en dos o tres dosis de por vida17.
Se debe añadir biotina 10 mg/día en convulsiones asociadas con la deficiencia de biotinidasa que se presentan como epilepsia de origen desconocido que no responde a otros tratamientos, usualmente en el segundo mes de vida y con erupción de la piel16. La dieta cetogénica es el mejor tratamiento para los neonatos con convulsiones debido a un defecto del transporte de glucosa16 (Fig. 2).
Consideraciones de tratamiento en enfermedades genéticas
Carbamazepina, oxcarbacepina a dosis bajas han mostrado efectividad en convulsiones neonatales familiares benignas18. Las encefalopatías graves causadas por mutaciones en KCNQ2 también pueden responder a estas drogas19. El mecanismo de acción no es completamente claro. La quinidina ha mostrado eficacia en animales y casos aislados con mutaciones del gen KCNT1, pero su eficacia no se demostró en otros estudios y tiene el potencial de efectos adversos de origen cardíaco20. Los estudios disponibles son pequeños u observacionales y no han sido rigurosamente diseñados. Las convulsiones debidas a causa aguda sintomática generalmente se resuelven en horas o días después del inicio, lo que dificulta evaluar el efecto de fármacos anticonvulsivantes, especialmente si son usados como segunda o tercera línea21. Muchos de estos neonatos reciben medidas de neuroprotección como hipotermia la cual podría también tener un efecto anticonvulsivante, y otras medidas emergentes como xenón, eritropoyetina, creatina, alopurinol, melatonina o sevofluorano, todas ellas aún en fase de prueba22.
Consideraciones adicionales
La duración apropiada de la terapia anticonvulsivante depende del riesgo de reaparición de las convulsiones si la terapia se suspende. El riesgo de epilepsia en neonatos con convulsiones es de 10% a 30%. Tres factores importantes ayudan a refinar la determinación del riesgo. En primer lugar el examen neurológico neonatal, siendo mayor el riesgo convulsivo en neonatos con examen neurológico anormal. El segundo factor es la etiología. Por ejemplo, el riesgo es mayor en asfixia neonatal o en displasias corticales que en convulsiones hipocalcémicas. En tercer lugar están los hallazgos en el EEG. Un EEG con actividad epileptiforme demuestra un riesgo aumentado de convulsiones posteriores. Algunos estudios han demostrado que la suspensión temprana del fenobarbital no tiene efecto sobre el pronóstico a largo plazo. En casos selectos, algunos autores recomiendan suspender el fenobarbital en el momento de dar el alta de la unidad neonatal. No es el mismo caso con otras medicinas menos tóxicas como el levetiracetam o topiramato. Sin embargo, otros estudios han demostrado también su posible efecto nocivo en aspectos motores y cognitivos cuando se evaluó el desarrollo infantil usando la escala de Bailey.
La Organización Mundial de la Salud recomienda considerar disminuir las medicinas anticonvulsivantes después de 72 horas de tratamiento si el examen neurológico y el EEG son normales. Los hallazgos de las imágenes diagnósticas pueden ayudar a determinar el riesgo-beneficio de la duración de la terapia. En neonatos con múltiples medicinas anticonvulsivantes, se las debe suspender una a una y gradualmente. El fenobarbital debe ser el último en ser suspendido.
No hay lineamentos específicos acerca del intervalo de tiempo entre la administración secuencial de los diferentes fármacos. Un tiempo entre 10-30 minutos entre intervenciones podría ser adecuado pero ninguna receta reemplaza a la presencia del médico durante el tratamiento del estatus neonatal. Es necesario establecer un tratamiento racional. Hay que tratar de evitar hipotensión o compromiso respiratorio que puedan causar mayor daño que el tratamiento administrado. La comunicación con neonatólogos es esencial ya que puede ocurrir que no se logre el control completo de las convulsiones y sea necesario tratar de evitar complicaciones.
En conclusión, las convulsiones neonatales son una causa frecuente de consulta en la unidad de cuidados intensivos neonatales, particularmente en prematuros y recién nacidos de bajo peso. El diagnóstico y el tratamiento son complejos porque hacer el diagnóstico es difícil especialmente si no se cuenta con métodos de monitoreo mediante EEG, y a veces aun cuando están a disposición, porque la interpretación de estos estudios es difícil y porque hay controversia en el grado de agresividad del tratamiento. Esta controversia se evidencia en la ausencia de protocolos para tratar estatus neonatal en contraposición a lo que ocurre en las terapias de convulsiones en niños mayores. A pesar de que hay nuevas drogas, el tratamiento no ha variado sustancialmente en los últimos años y depende de la etiología; pero una intervención temprana y oportuna puede mejorar el pronóstico. Aunque ha habido avances en el nivel de los sistemas de monitoreo en los últimos años, éstos no están disponibles para todos. La disponibilidad de nuevas drogas, especialmente más efectivas, ha sido lenta o prohibitiva por su costo. Los avances en el diagnóstico genético y metabólico, especialmente de los trastornos curables o prevenibles han sido el mayor progreso de los últimos años. En la práctica, la introducción de levetiracetam y métodos de neuroprotección como la hipotermia cerebral son progresos importantes, sin embargo el clínico todavía debe hacer todo esfuerzo para descartar entidades médicas cuya resolución dependa de un tratamiento inmediato.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Pearl PL. New treatment paradigms in neonatal metabolic epilepsies. J Inherit Metab Dis 2009; 32: 204-13.
2. Pearl PL. Amenable treatable severe pediatric epilepsies. Semin Pediatr Neurol 2016; 23: 158-66.
3. Lilien LD, Grajwer LA, Pildes RS. Treatment of neonatal hypoglycemia with continuous intravenous glucose infusion. J Pediatrics 1977; 91: 779-82.
4. MJ Painter, C Pippenger, H MacDonald, et al.: Phenobarbital and diphenylhydantoin levels in neonates with seizures. J Pediatr 1978; 92: 315-19.
5. Shirer AE. Fosphenytoin sodium (Cerebyx, Parke-Davis): Where will it fit in? In Question-of-the-Month, Westchester, NY: 1996 Drug Intelligence Center.
6. Morton LD. Clinical experience with fosphenytoin in children. J Child Neurol 1998; 13: S19-S22.
7. Takeoka, KS Krishamoorthy, TB Soman, Caviness VS Jr. Fosphenytoin in infants. J Child Neurol 1998; 13: 537-40.
8. Wolff M, Johannesen KM, Hedrich UBS, et al. Genetic and phenotypic heterogeneity suggest therapeutic implications in SCN2A-related disorders. Brain 2017; 140: 1316-36.
9. Dilena R, Striano P, Gennaro E, et al. Efficacy of sodium channel blockers in SCN2A early infantile epileptic encephalopathy. Brain Dev 2017; 39: 345-8.
10. Maytal J, Novak GP, King KC: Lorazepam in the treatment of refractory neonatal seizures. J Child Neurol 1991; 6: 319-23.
11. Smith BT, Masotti RE. Intravenous diazepam in the treatment of prolonged seizure activity in neonates and infants. Dev Med Child Neurol 1971; 13: 630-4.
12. Sheth RD, Buckley DJ, Gutierrez AR, Gingold M, Bodensteiner JB, Penney S. Midazolam in the treatment of refractory neonatal seizures. Clin Neuropharmacol 1996; 19: 165-70.
13. Hellström-Westas L, Westgren U, Rosén I, Svenningsen NW. Lidocaine for treatment of severe seizures in newborn infants. I. Clinical effects and cerebral electrical activity monitoring. Acta Paediatr Scan 1988; 77: 79-84.
14. Mruk AL, Garlitz KL, Leung NR. Levetiracetam in neonatal seizures: a review. J Pediatr Pharmacol Ther 2015; 20: 76-89.
15. Koh S, Jensen FE. Topiramate blocks perinatal hypoxia-induced seizures in rat pups. Ann Neurol 2001; 50: 366-72.
16. Volpe J, Inder T, Darras B, deVries L, du Plessis A, Neil J, Perlman J: Volpe’s Neurology of the Newborn, Sixth Edition. 2018; p 317.
17. Torres A, Newton SA, Crompton B, et al. CSF 5-methyltetrahydrofolate serial monitoring to guide treatment of congenital folate malabsorption due to proton-coupled folate transporter (PCFT) deficiency. JIMD Rep 2015; 24: 91-6.
18. Sands TT, Balestri M, Bellini G, et al. Rapid and safe response to low-dose carbamazepine in neonatal epilepsy. Epilepsia 2016; 57: 2019-30.
19. Pisano T, Numis AL, Heavin SB, et al. Early and effective treatment of KCNQ2 encephalopathy. Epilepsia 2015; 56: 685-91.
20. Milligan CJ, Li M, Gazina EV, et al. KCNT1 gain of function in 2 epilepsy phenotypes is reversed by quinidine. Annals Neurol 2014; 75: 581-90.
21. Soul JS. Acute symptomatic seizures in term neonates: Etiologies and treatments. Semin Fetal Neonatal Med 2018; 23: 183-190.
22. Orbach SA, Bonifacio SL, Kuzniewicz MW, Glass HC. Lower incidence of seizure among neonates treated with therapeutic hypothermia. J Child Neurol 2014; 29: 1502-7.
