Resumen Las enfermedades desmielinizantes constituyen un grupo de afecciones de etiología autoinmune
dirigida contra la mielina del sistema nervioso central. En muchos casos, el inicio del cuadro es precedido por una infección viral inespecífica. La esclerosis múltiple evoluciona con recaídas y remisiones con déficit neurológicos polifocales, siendo los más frecuentes la neuritis óptica, la mielitis transversa y el compromiso de tronco encefálico. Se caracteriza por lesiones hiperintensas que se observan en una resonancia magnética nuclear (RMN) en T2 y FLAIR peri-ventriculares y peri-callosas, cerebelo, tronco y médula espinal. La neuromielitis óptica se caracteriza por la presencia de neuritis óptica y mielitis transversa asociada a síndrome de área postrema y diencefálico. Las lesiones en RMN se distribuyen en los sectores ricos en acuaporina-4 (AQP-4): hipotálamo, peri tercer y cuarto ventrículo, nervios ópticos y médula espinal. Los anticuerpos anti AQP4 ayudan al diagnóstico aunque no son esenciales para el mismo. La encefalomielitis diseminada aguda es un cuadro clásicamente monofásico caracterizado por una encefalopatía aguda asociada a lesiones en RMN hiperintensas en T2 y FLAIR bilaterales, asimétricas, de gran tamaño y de bordes irregulares. En los tres casos, el líquido cefalorraquídeo (LCR) puede mostrar pleocitosis e hiperproteinorraquia. La presencia de bandas oligoclonales en LCR es característica de la esclerosis múltiple. En todos los casos, el tratamiento agudo incluye corticoides a altas dosis por vía endovenoso y en caso de no respuesta, plasmaféresis. Tanto la esclerosis múltiple como la neuromielitis óptica requieren tratamiento a largo plazo para evitar nuevas recaídas ya que se trata de enfermedades recurrentes.
Palabras clave: enfermedades desmielinizantes, esclerosis múltiple, neuromielitis óptica, encefalomielitis diseminada aguda
Abstract Demyelinating disorders. Demyelinating diseases are a group of conditions of autoimmune etiology
directed against the myelin of the central nervous system. In many cases, the onset of the illness is preceded by a nonspecific viral infection. Multiple sclerosis is a disease that evolves with relapses and remissions with polyfocal neurological deficits, being the most frequent optic neuritis, transverse myelitis and encephalic trunk involvement. Typically, magnetic resonance image (MRI) shows peri-ventricular, peri-callosal, cerebellum, brain stem and spinal cord hyperintensive lesions in T2 and FLAIR weighted images. Optic neuromyelitis is characterized by the presence of optic neuritis and transverse myelitis associated with the postrema and diencephalic area syndrome. MRI lesions are distributed in sectors rich with aquaporine-4 channels (AQP-4): hypothalamus, third and fourth ventricle, optic nerves and spinal cord. Finding anti AQP4 antibodies is useful for the diagnosis although they are not essential for it. Acute disseminated encephalomyelitis is typically a monophasic condition characterized by acute encephalopathy associated with hyperintense MRI large, bilateral and irregular asymmetric lesion in T2 and FLAIR weighted images. In all three cases, cerebral spine fluid (CSF) can show pleocytosis and hyperproteinorrachia. The presence of oligoclonal bands in CSF is characteristic of multiple sclerosis. In all cases, acute treatment includes high dose intravenous corticosteroids and plasmapheresis in non-responsive cases. Both multiple sclerosis and optic neuromyelitis require long-term treatment to prevent relapse and recurrent diseases.
Key words: demyelinating diseases, multiple sclerosis, optic neuromyelitis, acute disseminated encephalomyelitis
e-mail: andreagsavransky@gmail.com
Las enfermedades desmielinizantes del SNC (EDSN) constituyen un desafío diagnóstico en la neurología infantil. Cuando el sistema inmune, por algún motivo se activa adecuadamente, resulta beneficioso para el paciente. Sin embargo, en las EDSN generalmente el sistema inmune se activa, desencadenado por infecciones previas, provocando la destrucción de la mielina normalmente formada.
Las EDSN pueden ser monofásicas o recurrentes. El espectro clínico es muy amplio. En este caso se describirán las enfermedades más frecuentes que comprometen al sistema nervioso central: esclerosis múltiple (EM), neuromielitis óptica (NMO) y encefalomielitis diseminada aguda (EAD).
Esclerosis múltiple
La esclerosis múltiple (EM) es una enfermedad crónica inflamatoria autoinmune caracterizada por desmielinización y pérdida axonal. Hoy en día se sabe que la misma ocurre en individuos genéticamente predispuestos sobre los cuales factores ambientales activan células inmunes que atraviesan la barrera hemato-encefálica y se unen a proteínas de la mielina activando la cascada inflamatoria. En diversos estudios la presencia de uno o más alelos de antígeno leucocitario humano HLA-DRB15 se asoció con mayor riesgo de EM1 . Entre los factores ambientales de relevancia se encuentra la deficiencia de vitamina D1.
La prevalencia mundial de la EM en pediatría es desconocida, pero se estima que representa el 2 al 10% de todos los pacientes con EM. La mayoría de los casos ocurren entre los 13 a los 16 años, con predominio en el sexo femenino2.
La EM es por definición una enfermedad crónica y progresiva, por lo cual su detección temprana y tratamiento precoz pueden cambiar su curso. Por lo tanto, el diagnóstico en pediatría representa un desafío.
El diagnóstico de EM sigue siendo esencialmente clínico, debiendo encontrarse signos y síntomas que reflejen el compromiso de la sustancia blanca del SNC con diseminación en tiempo (DIT) y en espacio (DIS). La DIT puede ser confirmada clínicamente por la sucesión de brotes o exacerbaciones seguidos de períodos de remisión neurológica. La DIS se confirma por la distribución de las lesiones desmielinizantes en el SNC.
Según la última revisión del Grupo Internacional Pediátrico para el Estudio de la Esclerosis Múltiple publicado en 2013 por Krupp y col., se puede diagnosticar EM en pediatría en cuatro escenarios posibles:
1. Dos o más eventos clínicamente inflamatorios del SNC no encefalopáticos con más de 30 días de intervalo, comprometiendo más de un área del SNC.
2. Un evento no encefalopático típico de EM asociado a:
• RM cumpliendo criterios de McDonald 2010 para DIS
• RM siguiente mostrando una o más lesiones nuevas con o sin refuerzo con contraste (DIT)
3. Un evento típico de encefalomielitis diseminada aguda seguido de un evento no encefalopático separado por tres meses, asociado a lesiones en RM que cumplen criterios de McDonald 2010 para DIS
4. Niños de 12 años o más que presentan un evento no encefalopático y que la RMN cumple criterios para DIS/DIT3,4.
Criterios de Mc Donald revisados en 2010. Criterios de RMN
DIS: Una o más lesiones en T2 en por lo menos 2 de las 4 áreas típicas de afectación:
1. Periventricular
2. Yuxtacortical
3. Infratentorial
4. Médula espinal
DIT:
1. Aparición de una nueva lesión en T2 o lesión que capta con contraste en T1 con respecto a la resonancia previa, sin importar el tiempo luego del cual se realice.
2. Presencia simultánea de lesiones asintomáticas que capten y que no capten con el contraste en T1 en cualquier RMN5.
Según los criterios de Mc Donald de 2010 cuando se trata de DIS, las lesiones no deben ser las sintomáticas. Este concepto fue modificado en los criterios de Mc Donald 2017, pero esto aún no se encuentra validado para la población pediátrica6.
Con respecto al curso evolutivo de la EM puede dividirse en brotes y remisiones, y la forma progresiva que es muy poco frecuente en pediatría. Estas últimas pueden dividirse en primaria progresiva, cuando la progresión ocurre desde el inicio de la enfermedad y secundaria progresiva, cuando la progresión ocurre tras un período inicial de brotes y remisiones.
Las manifestaciones clínicas más frecuentes de la EM son:
– Neuritis óptica: se caracteriza por pérdida de la visión asociada a dolor peri-orbitario que empeora con los movimientos oculares. Muchas veces es monocular. Es habitual la discromatopsia sobre todo al rojo. En el examen físico el hallazgo característico es el defecto pupilar aferente. Puede asociar alteraciones del fondo de ojo (papilitis) o no (neuritis óptica retro bulbar).
– Mielitis aguda: las lesiones medulares son en general cortas y laterales, por lo cual en general dan cuadros incompletos. Los síntomas sensitivos (parestesias, hipoestesias) son más frecuentes que los motores.
– Síndromes por lesión de tronco del encéfalo: oftalmoplejía internuclear, síndromes pseudobulbares,
– Encefalopatía aguda
–Síndromes cerebelosos
– Otros síntomas asociados pueden incluir dolor, fatiga, trastornos miccionales y episodios paroxísticos (espasmos tónicos paroxísticos). En formas progresivas se describe el deterioro cognitivo y los trastornos de la marcha.
Como ya fue mencionado previamente, en todo paciente con sospecha clínica de EM debe realizarse RMN de cerebro y médula completa con y sin contraste endovenoso (EV) (gadolinio).
Lo hallazgos típicos incluyen lesiones multifocales y asimétricas distribuidas en la sustancia blanca semioval y adyacente a los ventrículos laterales y cuerpo calloso. Las mismas son hiperintensas en T2 y FLAIR. Son típicamente ovoideas y suelen mostrarse en distribución perpendicular al eje mayor del cuerpo calloso (dedos de Dawson). Las lesiones infratentoriales se ubican en el cerebelo, pedúnculos cerebelosos y protuberancia. En la médula espinal las lesiones son generalmente cortas (menos de tres metámeras) y laterales (Fig. 1).
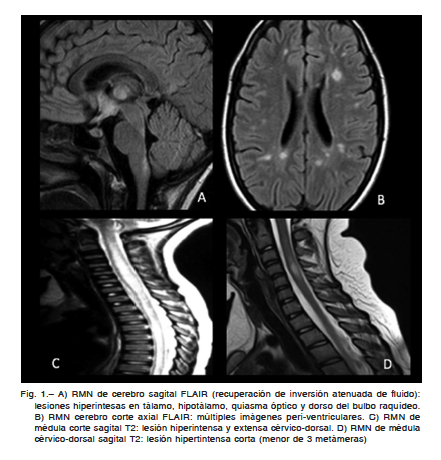
Ante la administración de contraste EV las lesiones pueden mostrar distintos patrones de realce: completo, incompleto o nodular7. Otros hallazgos en RMN son la presencia de lesiones hipointensas en T1 conocidas como agujeros negros y la atrofia encefálica difusa.
En la actualidad, gracias a la utilización de secuencias de susceptibilidad magnética (SWI) es posible identificar la distribución peri-venular de las lesiones desmielinizantes. Este hallazgo es poco frecuente en lesiones focales de la sustancia blanca no relacionadas con EM8.
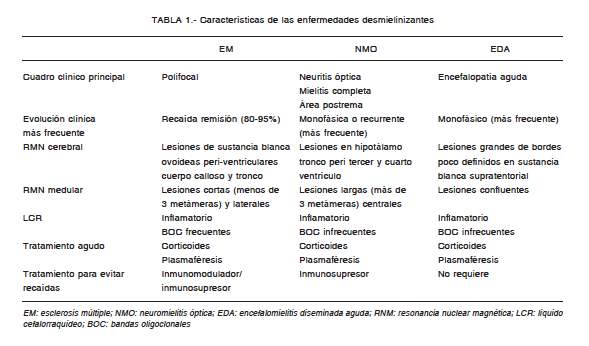
El análisis de LCR resulta de suma importancia en los pacientes con sospecha de EM. Durante la fase aguda de la enfermedad suele encontrarse pleocitosis a predominio mononuclear. La presencia de bandas oligoclonales (BOC) de IgG en LCR y ausentes en suero por enfoque isoeléctrico, ha sido informada en el 92% de los pacientes con EM en un estudio pediátrico9 (Tabla 1).
El tratamiento del paciente pediátrico con esclerosis múltiple incluye varios aspectos:
– Tratamientos de las recaídas: metilprednisolona EV 30 mg/kg/día por 5 días. En caso de no haber respuesta, se podrá realizar plasmaféresis (5 a 7 días en días alternos). Este último es un procedimiento no inmune selectivo que separa el plasma de los componentes sanguíneos corpusculares como los anticuerpos. Se recomienda administrar en forma conjunta ciclofosfamida 2 mg/kg/día vía oral de forma diaria hasta la finalización del último procedimiento. Si bien la cantidad de procedimientos recomendada es de 5 a 7, el número puede ser mayor dependiendo de la tolerabilidad y la respuesta clínica. Las complicaciones más frecuentes incluyen los trastornos hidroelectrolíticos sobre todo la hipocalcemia y las complicaciones asociadas al catéter (infección o trombosis). Se debe contar con un equipo entrenado en la realización de estos procedimientos. Se debe tener precaución en pacientes con un peso menor a 15 kg debido a la posibilidad de inestabilidad hemodinámica.
– Tratamientos sintomático
– Tratamiento específico inmunomodulador que tiene como objetivo limitar el fenómeno inflamatorio. Los mismos demostraron disminuir la tasa anual de recaídas y la actividad inflamatoria en resonancia magnética
Existen distintos fármacos para el tratamiento de la esclerosis múltiple. Diferentes series publicadas muestran la efectividad del Interferón beta y el acetato de glatiramer. Los mismos se administran por vía subcutánea10.
En 2013 Ghezzi y col. describieron un grupo de niños tratados con natalizumab quienes presentaron buena respuesta clínica y radiológica11. Sin embargo, hay que tener en cuenta el riesgo de leuco-encefalopatía multifocal progresiva, ya que se trata de una enfermedad potencialmente fatal causada por la reactivación del virus JC.
Se encuentran en realización distintos ensayos clínicos para uso de otras medicaciones como fingolimod, dimetylfumarato y teriflunomida12.
Neuromielitis óptica
La neuromielitis óptica (NMO) es una enfermedad inflamatoria autoinmune del SNC que se caracteriza clínicamente por ataques recurrentes de neuritis óptica y mielitis transversa (longitudinalmente extendida). La primera descripción fue realizada por Devic en 1894. Al principio se creía que era una variante de la esclerosis múltiple pero hoy se sabe que es una enfermedad diferente que se caracteriza por la presencia de anticuerpos específicos contra la acuaporina 4 (IgG-AQP4), el canal de agua más abundante del SNC que se expresa en los pies de los astrocitos asociados con los capilares, el epéndimo ventricular y las sinapsis interneuronales. Este canal regula el flujo de agua entre el cerebro y la sangre y entre el cerebro y el LCR13.
La edad media de presentación es de 8 años con un predominio en el sexo femenino (3:1). Muchos de los pacientes presentan previo al inicio un cuadro viral inespecífico y luego neuritis óptica asociada a mielitis transversa14.
La neuritis óptica en general es bilateral y con gran compromiso de la agudeza visual. La mielitis transversa es en general completa y extensa con compromiso motor bilateral, nivel sensitivo y disfunción esfinteriana. Clásicamente los pacientes asocian compromiso de tronco cerebral que incluye vómitos incoercibles (síndrome de área postrema) e hipo. El compromiso diencefálico se evidencia principalmente por trastornos hidroelectrolíticos15.
Si bien la el curso clínico puede ser monofásico, la mayoría presenta cursos recurrentes que pueden estar separados por meses o años. Muchos presentan asociación con otras enfermedades autoinmunes. La más frecuentes son enfermedad tiroidea y lupus eritematoso sistémico (LES). Sin embargo, existe asociación con diabetes, enfermedad celíaca y Sjögren. Incluso los auto-anticuerpos característicos de estas enfermedades pueden estar presentes aun sin manifestaciones clínicas de las mismas.
Los hallazgos en RM de los pacientes con NMO resultan muy característicos y se distribuyen en los lugares ricos en AQP4 como peri-tercer ventrículo (diencéfalo) y cuarto ventrículo (tronco). Estas lesiones resultan de suma importancia para establecer el diagnóstico diferencial con otras enfermedades desmielinizantes del SNC. Puede haber lesiones supra e infratentoriales (cerebelo). En un tercio de los pacientes las lesiones realzan con gadolinio. El compromiso de los nervios ópticos suele ser extenso y con compromiso del quiasma óptico. Las lesiones medulares suelen ser centro-medulares y extensas, comprometiendo más de tres metámeras consecutivas, con un patrón de captación por lo general heterogéneo16,17 (Fig. 1).
El LCR durante los períodos agudos muestra aumento de las proteínas y de la celularidad a predominio mononuclear. En algunos pacientes pueden encontrarse eosinófilos y las BOC son positivas en un pequeño porcentaje (Tabla 1).
Los criterios diagnósticos para NMO fueron cambiando a lo largo del tiempo. Actualmente se encuentran en vigencia los propuestos por el Grupo Internacional de Estudio de Esclerosis Múltiple Pediátrica17,18. En los mismos se subdivide a los pacientes con anticuerpos anti AQP4 y los que son negativos:
A. NMO con IgG-AQP4:
1. Uno o más eventos clínicos característicos
2. Positividad de anticuerpos anti AQP4 por el mejor método que se encuentre (ensayo basado en células)
3. Exclusión de otros diagnósticos
B. NMO con IgG-AQP4 negativos o desconocidos:
1. Dos o más eventos clínicos característicos y todos los siguientes:
– al menos uno de los eventos tiene que ser neuritis óptica, mielitis transversa o síndrome de área postrema
– diseminación en tiempo (dos o más eventos clínicos característicos)
– cumplir con los criterios radiológicos en RMN
2. Negatividad de anticuerpos anti AQP4 por el mejor método disponible (ensayo basado en células)
3. Exclusión de otros diagnósticos.
Eventos clínicos característicos:
1. Neuritis óptica
2. Mielitis transversa
3. Síndrome de área postrema
4. Síndrome de tronco cerebral agudo
5. Narcolepsia sintomática o síndrome diencefálico con las típicas lesiones en RMN
6. Síndrome cerebral sintomático con típicas lesiones de NMO en RMN
Requisitos adicionales en RMN:
1. Neuritis óptica: RMN de cerebro normal o con lesiones no específicas en sustancia blanca y señal hiperintensa en T2 de los nervios ópticos o realce con contraste de los mismos en T1. La lesión de los nervios ópticos involucra más de la mitad de su extensión o involucra al quiasma óptico.
2. Mielitis transversa: lesión intramedular que se extiende por más de tres segmentos continuos o cordón espinal atrófico en más de tres segmentos continuos en pacientes con antecedente de mielitis clínica.
3. Síndrome de área postrema: lesión en dorso del bulbo/área postrema.
4. Síndrome de tronco cerebral: lesiones peri-ependimarias en tronco cerebral.
La acuaporina 4 es el blanco de los anticuerpos que presentan los pacientes con NMO. Estos anticuerpos se cree que activarían la cascada del complemento provocando la endocitosis y degradación de la AQP4. Sin embargo, la vía del complemento no sería la única involucrada.
Recientemente se describieron la presencia de anticuerpos anti MOG (glicoproteína oligodendrocítica de la mielina) en pacientes con NMO seronegativos para IgG-AQP4. En ellos, el fenotipo característico es la neuritis óptica bilateral con papilitis y lesiones medulares más caudales con mejor recuperación19.
El tratamiento de la NMO incluye el manejo del evento agudo y la prevención de las recaídas. El primero está orientado a minimizar la secuela neurológica y recuperar la función. Se debe tratar con metilprednisolona EV 30 mg/kg (dosis máxima 1g) por 5 días consecutivos. En los que no responden a este tratamiento se debe considerar el recambio plasmático terapéutico en días alternos (5 a 7 ciclos). Para este último procedimiento es importante consultar con un equipo especializado en la realización del mismo para minimizar las posibles complicaciones20.
Para la prevención de las recaídas el tratamiento puede realizarse con: a) azatioprina (2-3mg/kg/día) vía oral, generalmente en combinación con meprednisona vía oral 1 mg/kg día, b) rituximab vía endovenosa (375 mg/m2 dosis por 4 dosis separadas semanalmente) o c) micofenolato mofetil vía oral (500-700 mg/m2). La elección del fármaco estará relacionada con la experiencia de cada centro con la droga, la vía de administración y los costos21-23”.
Encefalomielitis diseminada aguda
La encefalomielitis diseminada aguda (EDA) es un trastorno desmielinizante inflamatorio inmunomediado del SNC. Clínicamente se caracteriza por una encefalopatía aguda asociada a trastornos neurológicos multifocales. Clásicamente se describe como una enfermedad monofásica que afecta a la sustancia blanca encefálica con o sin compromiso de la médula espinal24. En el año 2017 el Grupo Internacional de Estudio de Esclerosis Múltiple Pediátrica propuso los siguientes criterios para el diagnóstico de EDA:
1. Primer evento clínico polifocal del SNC que impresiona de etiología desmielinizante
2. Encefalopatía (alteración de la conciencia y/o comportamiento que no puede ser explicada por fiebre, infección sistémica o estado post ictal)
3. RMN de cerebro debe mostrar lesiones desmielinizantes durante la fase aguda de instalación (3 meses)
4. No aparición de nuevos síntomas o lesiones de RMN de cerebro a los 3 meses o después25.
La EDA puede tener un curso clínico multifásico cuando un paciente presenta 2 o más eventos que cumplen con los criterios anteriormente mencionados y están separados por 3 meses.
La EDA puede manifestarse a cualquier edad pero es mucho más frecuente en edad pediátrica. La edad media de presentación es de 5 a 8 años y llamativamente es más frecuente en varones26.
La incidencia se estima en 0.3 a 0.6 cada 100 000 por año. Es probable que en los últimos años se observe un aumento de los casos diagnosticados probablemente por el advenimiento de las neuroimágenes que permite realizar diagnósticos de casos que anteriormente eran diagnosticados como meningoencefalitis.
La EDA puede clasificarse como post infecciosa o post vacunal. Luego de la infección (generalmente catarro de vía aérea superior) o la vacuna entre los 2 días y las 4 semanas, se instala el cuadro caracterizado por encefalopatía aguda. La progresión es rápida y en el 15 al 25% de los pacientes requieren asistencia en unidad de cuidados intensivos.
La encefalopatía puede ir desde la confusión hasta el coma. Las otras manifestaciones dependerán de la localización de las lesiones. Frecuentemente asocian compromiso motor, ataxia, convulsiones e incluso estado de mal epiléptico. El compromiso de la médula espinal es variable aunque puede ser difícil de diagnosticar debido al deterioro del sensorio27.
En todo paciente que se sospeche EDA debe realizarse RMN de cerebro. En la misma se podrán encontrar lesiones de gran tamaño, hiperintensas, en T2 y FLAIR, bilaterales y asimétricas, de bordes poco definidos. Las mismas se ubican en la sustancia blanca subcortical cerebral, cerebelo y tronco encefálico. En algunos pacientes puede encontrarse también compromiso en núcleos grises profundos. El compromiso de la médula espinal es variable, encontrándose frecuentemente lesiones confluentes que involucran varios segmentos medulares28.
El LCR, al igual que en las otras enfermedades desmielinizantes, muestra pleocitosis a predominio mononuclear. Puede asociar hiperproteinorraquia. Es importante el estudio de neurovirus en LCR para diferenciar el cuadro de lesión viral directa en SNC. Las bandas oligoclonales suelen ser negativas (Tabla 1).
Es importante el seguimiento en el tiempo de los pacientes con EDA ya que tanto la EM como la NMO pueden debutar con cuadros encefalopáticos. Si luego de los tres meses del cuadro clínico inicial que cumple criterios para EDA el paciente presenta recaída clínica no encefalopática y la RMN cumple criterios para DIS, se deberá pensar en EM. Si luego de los tres meses del evento clínico inicial que cumple criterios para EDA el paciente presenta recaída clínica como neuritis óptica, mielitis longitudinalmente extendida o síndrome de área postrema y tiene RMN compatible, se deberá pensar en NMO25.
Un grupo interesante de pacientes luego de presentar el cuadro clínico inicial muestran recaídas clínicamente caracterizadas por neuritis ópticas mostrando en la resonancia de cerebro resolución completa de las imágenes de sustancia blanca. Este grupo corresponde a ADEM-ON (accute disseminatted encephalomyelitis- optic neuritis) y se asocia a la presencia de anticuerpos anti MOG29.
El tratamiento incluye la terapia de sostén y el tratamiento antiinflamatorio. Como en los casos anteriores metilprednisolona 30 mg/kg/día por 5 días consecutivos.
Para los casos de fracaso o contraindicación de los corticoides, se deberá considerar el recambio plasmático terapéutico30. Esta entidad no requiere tratamiento a largo plazo.
El pronóstico es generalmente favorable con recuperación completa en semanas a meses. Sin embargo, en algunos pacientes se informaron secuelas cognitivas y de la conducta a largo plazo.
En conclusión, las enfermedades desmielinizantes son afecciones cada vez más frecuentes del SNC. Probablemente el avance en las técnicas diagnósticas, sobre todo la RMN de cerebro, nos permita conocer mejor estas enfermedades y su espectro clínico. La clínica sigue siendo fundamental para el diagnóstico de este tipo de enfermedades ya que muchas veces no se cuenta con un marcador biológico. El diagnóstico correcto orientará la elección terapéutica adecuada para cada paciente.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Banwell B, Bar-Or A, Arnold DL, et al. Clinical, environmental, and genetic determinants of multiple sclerosis in children with acute demyelination: A prospective national cohort study. Lancet Neurol 2011; 10: 436-45.
2. Tenembaum SN. Pediatric multiple sclerosis: Distinguishing clinical and MR imaging features. Neuroimaging Clin N Am 2017; 27: 229-50. 3. Tardieu M, Banwell B, Wolinsky JS. Consensus definitions for pediatric MS and other demyelinating disorders in childhood. Neurology 2016; 87: S8-11.
4. Krupp LB, Tardieu M, Amato MP, et al. International Pediatric Multiple Sclerosis Study Group criteria for pediatric multiple sclerosis and immune-mediated central nervous system demyelinating disorders: revisions to the 2007 definitions. Mult Scler J 2013; 19: 1261-7.
5. Polman CH, Reingold SC, Banwell B, et al. Diagnostic criteria for multiple sclerosis: 2010 Revisions to the McDonald criteria. Ann Neurol 2011; 69: 292-302.
6. Thompson AJ, Banwell BL, Barkhof F, et al. Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. Lancet Neurol 2018; 17: 162-73.
7. Arrambide G, Tintore M, Auger C, et al. Lesion topographies in multiple sclerosis diagnosis. Neurology 2017; 89: 2351-6.
8. Mistry N, Dixon J, Tallantyre E, et al. Central veins in brain lesions visualized with high-field magnetic resonance imaging. JAMA Neurol 2013; 70: 623-8.
9. Chitnis T. Pediatric demyelinating diseases. Continuum (Minneap) 2013; 19: 1023-45.
10. Ghezzi A, Amato MP. Pediatric multiple sclerosis: Conventional first-line treatment and general management. Neurology 2016; 87: S97-102.
11. Ghezzi A, Pozzilli C, Grimaldi L, et al. Natalizumab in pediatric multiple sclerosis: results of a cohort of 55 cases. Mult Scler J 2013; 19:1106-12.
12. Chitnis T, Ghezzi A, Bajer-Kornek B, Boyko A, Giovannoni G, Pohl D. Pediatric multiple sclerosis. Clin Neuroimmunol 2011:157-77.
13. Lennon VA, Wingerchuk DM, Kryzer TJ, et al. A serum autoantibody marker of neuromyelitis optica: distinction from multiple sclerosis. Lancet 2004; 364: 2106-12.
14. Pandit L, Asgari N, Apiwattanakul M, et al. Demographic and clinical features of neuromyelitis optica: A review. Mult SclerJ 2015; 21: 845-53.
15. Kremer L, Mealy M, Jacob A, et al. Brainstem manifestations in neuromyelitis optica: a multicenter study of 258 patients. Mult Scler J 2014; 20: 843-7.
16. Absoud M, Lim MJ, Appleton R, et al. Paediatric neuromyelitis optica: clinical, MRI of the brain and prognostic features. J Neurol Neurosurg Psychiatry 2015; 86: 470-2.
17. Tenembaum S, Chitnis T, Nakashima l, et al. Neuromyelitis optica spectrum disorders in children and adolescents. Neurology 2016; 87: S59-66.
18. Wingerchuk DM, Banwell B, Bennett JL, et al. International consensus diagnostic criteria for neuromyelitis optica spectrum disorders. Neurology 2015; 85: 177-89.
19. Kitley J, Waters P, Woodhall M, et al. Neuromyelitis optica spectrum disorders with aquaporin-4 and myelin-oligodendrocyte glycoprotein antibodies. JAMA Neurol 2014; 71: 276-83.
20. Kimbrough DJ, Fujihara K, Jacob A, et al. Treatment of neuromyelitis optica: Review and recommendations. Mult Scler Relat Disord 2012; 1:180-7.
21. Elsone L, Kitley J, Luppe S, et al. Long-term efficacy, tolerability and retention rate of azathioprine in 103 aquaporin-4 antibody-positive neuromyelitis optica spectrum disorder patients: a multicentre retrospective observational study from the UK. Mult Scler J 2014; 20: 1533-40.
22. Mahmood NA, Silver K, Onel K, Ko M, Javed A. Efficacy and safety of rituximab in pediatric neuromyelitis optica. J Child Neurol 2011; 26: 244-7.
23. Jacob A, Matiello M, Weinshenker BG, et al. Treatment of neuromyelitis optica with mycophenolate mofetil. Arch Neurol 2009; 66: 1128-33.
24. Tenembaum S, Chitnis T, Ness J, Hahn JS, International Pediatric MS Study Group. Acute disseminated encephalomyelitis. Neurology 2007; 68: S23-36.
25. Pohl D, Alper G, Van Haren K, et al. Acute disseminated encephalomyelitis. Neurology 2016; 87: S38-45.
26. Leake JAD, Albani S, Kao AS, et al. Acute disseminated encephalomyelitis in childhood: epidemiologic, clinical and laboratory features. Pediatr Infect Dis J 2004; 23:756-64.
27. Tenembaum S, Chamoles N, Fejerman N. Acute disseminated encephalomyelitis: a long-term follow-up study of 84 pediatric patients. Neurology 2002; 59: 1224-31.
28. Callen DJA, Shroff MM, Branson HM, et al. Role of MRI in the differentiation of ADEM from MS in children. Neurology 2009; 72: 968-73.
29. Hennes EM, Baumann M, Schanda K, et al. Prognostic relevance of MOG antibodies in children with an acquired demyelinating syndrome. Neurology 2017; 89: 900-8.
30. Pohl D, Tenembaum S. Treatment of acute disseminated encephalomyelitis. Curr Treat Options Neurol 2012; 14: 264-75.
