FERNANDO DI TULLIO, GLENDA ERNST, FÉLIX VIGOVICH, CLAUDIA SHANLEY, FELIPE CHERTCOFF, MARTÍN BOSIO
Centro de Medicina Respiratoria, Hospital Británico de Buenos Aires, Argentina
Resumen El mieloma múltiple es una enfermedad oncohematológica, que representa el 15% de las enfermedades hematológicas malignas. La edad media de aparición es entre los 65-70 años, siendo muy poco frecuente en pacientes jóvenes; 2% son menores de 40 años. Presentamos el caso de una mujer de 36 años con antecedente de tabaquismo de 20 paquetes año. Consultó por disnea asociada a signos de insuficiencia cardíaca derecha, anemia, proteinuria, elevación de reactantes de fase aguda y patrón sugestivo de restricción moderadamente grave en la espirometría y caída de la capacidad de difusión de monóxido de carbono (DLco). El ecocardiograma doppler evidenció dilatación de cavidades derechas y signos de hipertensión pulmonar que se confirmó con cateterismo cardiaco derecho. En busca de la etiología se arribó al diagnóstico de mieloma múltiple.
Palabras clave: mieloma múltiple, hipertensión pulmonar, disnea, hipertensión pulmonar transitoria
Abstract Pulmonary hypertension as presentation in multiple myeloma. Multiple myeloma is a hemato-
logic disease, which accounts for 15% of hematologic malignancies. The average age of onset is between 65-70 years and is very rare in young patients, as 2% are under 40 years old. We present a case of 36-year-old women with history of 20 pack years (p/y) smoking, who complaints of dyspnea associated with signs of right cardiac overload, anemia, proteinuria, elevated acute phase reactants and spirometry pattern suggestive of moderately-severe restriction and severe drop in diffusing capacity for carbon monoxide (DLCO). Echocardiogram evidence dilated right heart cavities and signs of pulmonary hypertension which is confirmed by right heart catheterization. In search of the etiology we arrive to the diagnosis of multiple myeloma.
Key words: multiple myeloma, pulmonary hypertension, dyspnea, transient pulmonary hypertension
Recibido: 24-XI-2017 Aceptado: 25-VII-2018
Dirección postal: Fernando Di Tullio, Laboratorio Pulmonar, Hospital Británico de Buenos Aires, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: fer_dit@hotmail.com
El mieloma múltiple (MM) es una enfermedad oncohematológica, que representa el 15% de las neoplasias hematológicas1. La edad media de aparición es entre los 65-70 años, siendo muy poco frecuente en jóvenes; 2% son menores de 40 años2.
La hipertensión pulmonar (HTP) asociada a MM es poco frecuente y se postulan diferentes mecanismos fisiopatológicos. Se han descripto casos en los que la HTP es secundaria a tromboembolismo pulmonar (TEP) crónico, debido a mayor riesgo del mismo asociado a MM, amiloidosis cardíaca y vascular pulmonar3 y relacionados al tratamiento, principalmente con talidomida4, 5. También se propone la intervención de mediadores inflamatorios liberados por las células neoplásicas como mecanismo causal6.
Caso clínico
Mujer de 36 años, con antecedente de tabaquismo de 20 paquetes año, consultó por astenia, adinamia y registros febriles aislados de 3 meses de evolución. Refirió pérdida de peso de 6 kg y 15 días previos a la consulta, tos no productiva y disnea progresiva hasta clase funcional IV (clasificación de la New York Heart Association –NYHA–)7. Presentó palidez cutáneomucosa, examen respiratorio normal y saturación de oxigeno 98% al aire ambiente. Se auscultó aumento del segundo ruido cardíaco y se evidenció ingurgitación yugular 3/3 sin colapso inspiratorio, edemas en miembros inferiores 3/6 de localización perimaleolar y hepatomegalia dolorosa.
El laboratorio reveló anemia normocítica normocrómica (hemoglobina: 6.6 g/dl, prueba de Coombs directa e indirecta negativas, valores normales de reticulocitos y de bilirrubina indirecta; elevación de reactantes de fase aguda (VSG > 120 mm 1°h, PCR 3.1 mg/dl) y función renal normal; aumento de la proteínas totales (9.8 g/dl), pro-BNP (2710 ng/l) y troponina T (20 ng/l); sedimento urinario no inflamatorio y proteinuria en rango nefrótico (3.86 g/24 h).
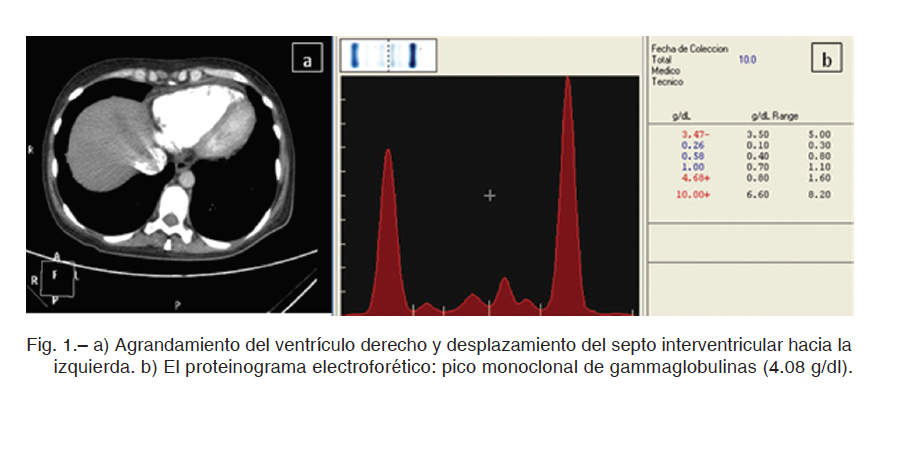
La radiografía de tórax mostró agrandamiento de la silueta cardíaca, sin evidencia de lesiones parenquimatosas pulmonares. Presentó electrocardiograma con ritmo sinusal, frecuencia cardíaca de 90 latidos por minuto y ondas T negativas en las derivaciones precordiales. El ecocardiograma doppler informó dilatación de aurícula derecha (área de 24 cm2) y ventrículo homolateral, aplanamiento sisto-diastólico del septum interventricular hacia el ventrículo izquierdo e insuficiencia tricuspídea moderada que permitió estimar presión sistólica de la arteria pulmonar de 52 mmHg, con velocidad pico de regurgitación tricuspidea de 3.08 m/s. La función del ventrículo izquierdo estaba conservada y la del derecho levemente deteriorada (TAPSE 15-16 mm), sin signos de miocardiopatía infiltrativa. Por sospecha de TEP, se realizó angiotomografía que lo descartó; se evidenció agrandamiento del ventrículo derecho y desplazamiento del tabique interventricular hacia la izquierda (Fig. 1a).
Se realizó cateterismo cardíaco derecho (CCD) que informó: presión sistólica de la arteria pulmonar (PSAP) 48 mmHg, presión diastólica de la arteria pulmonar (PDAP) 21 mmHg, presión media de la arteria pulmonar (PMAP) 31 mmHg, presión de wedge (PW) 9 mmHg, confirmándose el diagnóstico de hipertensión arterial pulmonar (HAP).
El examen funcional respiratorio sugirió restricción moderadamente grave (FVC 2.57l [59%]) y disminución grave de la difusión (DLco 10.61 ml/min/mmHg [33%]). El test de marcha de 6 minutos (TC6M) mostró escasa distancia recorrida (280 metros –m–), caída significativa de la saturación de oxígeno alcanzando 78% y disnea moderada, medida por escala de Borg, luego de terminada la prueba.
Se diagnosticó HTP con criterios de gravedad ante evidencia clínica de falla del ventrículo derecho, rápida progresión de los síntomas, disnea CF IV (NYHA), TC6M <300 m y pro-BNP elevado8.
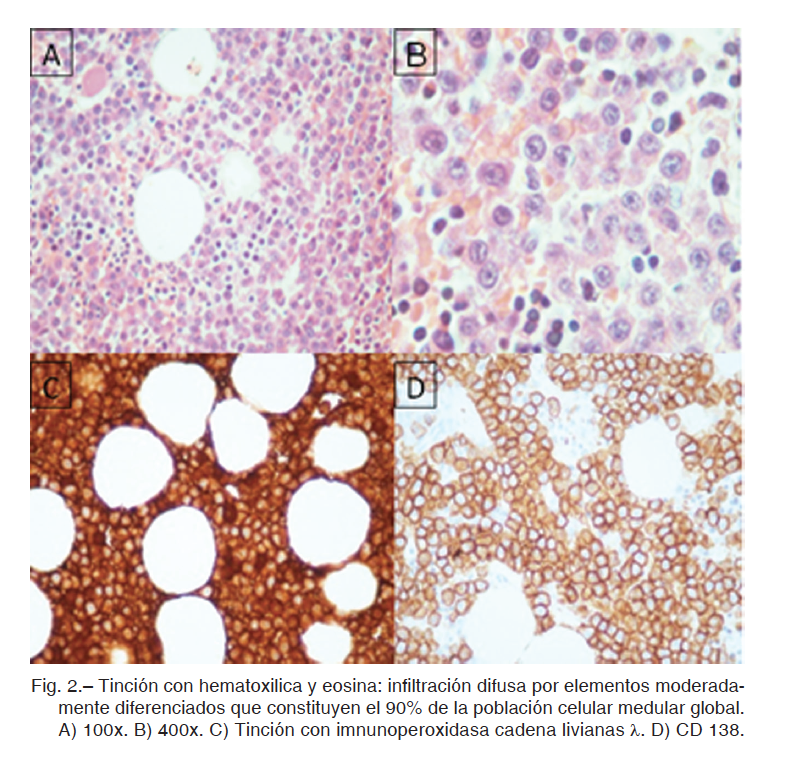
Se realizaron estudios para determinar etiología de la hipertensión pulmonar: centellograma V/Q que presentó baja probabilidad de TEP, perfil tiroideo dentro de los valores normales (TSH 0.25 uU/ml, T4L 1ng/dl, T3 96 ng/dl), serología HIV negativa. La ecografía abdominal evidenció hepatomegalia y riñones estructuralmente normales. Se solicitó perfil inmunológico: factor reumatoideo <9 U/ml; FAN, anti-DNA, ANCA-C, ANCA-P, anti-RNP, anti-Sm, anti-Ro, anti-La y anti-SCL-70 negativos. IgG e IgM anti-cardiolipinas normales, inhibidor lúpico negativo. El proteinograma electroforético reveló proteínas totales de 8.9 g/dl, albúmina 2.8g/ dl y gammaglobulinas de 4.08g/dl con banda monoclonal en gamma de baja movilidad (Fig. 1b). Cadenas Kappa suero: precipitación policlonal, cadenas Lambda suero: precipitación monoclonal. Por inmunofijación se caracterizó al componente monoclonal como IgG Lambda (IgG 6904 mg/dl e inmunoparesia). El laboratorio mostró elevación de LDH: (888 U/l) y beta2microglobulina: (3.3mg/l), calcio y clearance de creatinina normales y cadenas livianas lambda positivo en orina. En base a estos hallazgos se realizó biopsia de médula ósea que evidenció infiltración plasmocítica medular del 90% cuya inmunomarcación mostró positividad de CD138, IgG positivo y cadenas livianas Lambda positivo en plasmocitos (Fig. 2). Rojo congo negativo, estudio citogenético normal, FISH: t(4;14); t(14:16) y t(14;20): negativo, FISH del 17p13.1 Gen P53: negativo.
Con diagnóstico de MM IgG Lambda, estadio ISS (IMWG) II, R-ISS II9, se decide comenzar tratamiento con esquema CyBorD (ciclofosfamida, bortezomib y dexametasona) y no incluir inmunomoduladores (IMIDs) por el riesgo trombótico y por la posibilidad de empeorar su hipertensión pulmonar. Se asoció sildenafil para la HTP. Se indicó el primer ciclo CyBorD a dosis reducida para evaluar tolerancia y a partir del segundo ciclo recibió dosis plena con muy buena tolerancia y respuesta. El TC6M denotó mejoría significativa luego de 13 días de tratamiento (360 m), menor disnea y saturación final de 96%. Se realizó nuevo ecocardiograma doppler sin cambios con respecto al previo por lo que se inició tratamiento con ambrisentán.
Durante el seguimiento se evidenció mejoría clínica significativa, mejorando la disnea y debilidad así como también los edemas en miembros inferiores y la proteinuria. Los biomarcadores de injuria miocárdica alcanzaron sus valores normales. Luego de 6 ciclos de tratamiento y en remisión completa por parámetros bioquímicos y medulares, se consolidó respuesta con trasplante autólogo de médula ósea sin presentar complicaciones. Tres meses después del trasplante comenzó mantenimiento con lenalidomida 15 mg/día. Al año del diagnóstico se realizó nuevo CCD mostrando normalización de los valores hemodinámicos con una PSAP de 25 mmHg, PDAP de 6 mmHg y PMAP de 15 mmg, manteniendo remisión de su enfermedad hematológica. Completó 2 años de mantenimiento con lenalidomida. Actualmente la paciente se encuentra sin tratamiento para MM y HTP.
Discusión
La HTP se define como PMAP ≥ 25 mmHg en reposo medida con CCD. El término HAP describe HTP precapilar con presión de wedge ≤ 15mmHg y resistencias vasculares > 3 unidades Wood8. El CCD es el gold standard para el diagnóstico de HTP y HAP. La HTP del grupo II, secundaria a enfermedad cardíaca, corresponde a la causa más frecuente de HTP y en segundo lugar se encuentran las del grupo III, asociada a enfermedades pulmonares e hipoxemia10. Habiendo descartado estos
dos grupos y la de grupo IV (tromboembolismo crónico) arribamos al diagnóstico de MM como causa de HTP (según la clasificación de las guías Niza 2013 grupo V, de causa multifactorial, no aclarada)11.
El MM es una enfermedad oncohematológica descripta en la literatura como causa poco frecuente de HTP, asociándose especialmente con el síndrome POEMS12, afecta principalmente a personas mayores de 60 años, es poco frecuente en pacientes jóvenes2. La prevalencia de hipertensión pulmonar en pacientes con mieloma múltiple se desconoce. La asociación entre estas dos entidades no ha sido profundamente estudiada, pero podemos inferir, por estudios retrospectivos, que la hipertensión pulmonar de grupo II, asociada a enfermedad cardiaca, es la que más frecuentemente se asocia a MM debido al grupo etario que compromete12. El MM es una enfermedad protrombótica que, por diferentes mecanismos, incluidos la formación de anticuerpos procoagulantes, resistencia a la proteína C activada en ausencia de mutaciones del factor V de Leiden, interferencia de inmunoglobulinas con la estructura de la fibrina y daño endotelial producido por citoquinas inflamatorias4 aumentan la probabilidad de TEP, siendo la forma crónica un mecanismo probable de hipertensión pulmonar13. El método más sensible para descartar TEP crónico es el centellograma ventilación/ perfusión, presenta una sensibilidad de 96%14. En el caso presentado tanto el centellograma como la angiotomografía descartaron esta entidad.
Los depósitos en la vasculatura pulmonar y cardiacos de amiloide corresponden a otro mecanismo por el cual se puede desarrollar HTP en pacientes con MM. En nuestra paciente no se evidenciaron depósitos amiloides en las biopsias de grasa abdominal, ni en médula ósea, tampoco se evidenció infiltración cardiaca por ecocardiograma, si bien el gold estándar para el diagnóstico es la biopsia miocárdica15, 16.
Otro mecanismo generador de HTP en el MM es el aumento de los mediadores inflamatorios, liberados por células neoplásicas, que aumentarían la viscosidad sanguínea y producirían una reacción vasoactiva en los vasos pulmonares4. En los casos descriptos en la literatura, estos factores han sido transitorios y la hipertensión pulmonar revirtió a los pocos días de iniciar el tratamiento de la enfermedad hematológica (entre 10 a 21 días)3. En nuestra paciente esto se evidenció con la mejoría clínica, el test de marcha de 6 minutos, los marcadores sanguíneos de injuria miocárdica y se confirmó posteriormente con el CCD. Suponemos que los citotóxicos y los esteroides sistémicos fueron la principal razón de su mejoría al reducir el número de células neoplásicas y así los mediadores inflamatorios. Se ha descripto que en el síndrome de POEMS se liberan citoquinas proinflamatorias como la IL1B, IL-6 y factor de necrosis tumoral que podría tener un rol en la patogénesis de HTP3.
La talidomida, droga utilizada en el tratamiento de primera línea para el tratamiento del MM, ha sido descripta como causa de HTP por su efecto protrombótico o por otros mecanismo sin estar asociada a éste5,6. Los quimioterápicos están incluidos en las guías Niza como posibles agentes etiológicos de HTP11.
En la literatura hemos encontrado dos casos en los que la HTP es la manifestación inicial del MM, ambos eran hombres, menores de 45 años en los que la HTP fue secundaria a mediadores inflamatorios liberados por células tumorales que mostraron una muy buena respuesta a los esteroides sistémicos y quimioterapia3,16, como ocurrió en el caso presentado. A nuestro entender este es el primer caso en que se presenta en una paciente mujer también dentro de ese grupo etario.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Becker N. Epidemiology of multiple myeloma. Recent Results Cancer Res 2011; 183: 25-35.
2. Bladé J, Kyle R. Multiple myeloma in young patients: clinical presentation and treatment approach. Leuk Lymphoma 1998; 30: 493-501.
3. Rostagno C, Rostagno P. Pulmonary hypertension and multiple myeloma. Clin Med Res 2013; 2: 73-6.
4. Villa A, Mazzola AA, Ghio S, Martinoli E, Marino P. Reversible pulmonary hypertension related to thalidomide treatment for multiple myeloma. Case Rep Oncol 2011; 4: 487-9.
5. Lafaras C, Mandala E, Verruo E, et al. Non-thromboembolic pulmonary hypertension in multiple myeloma, after thalidomide treatment: a pilot study. Ann Oncol 2008; 19: 1765-9.
6. Rostagno C, Ciolli S, Prisco D. An unusual case of pulmonary hypertension in a young male. Intern Emerg Med 2006; 1: 127-32.
7. The Criteria Committee of the New York Heart Association. Diseases of the Heart and Blood Vessels: Nomenclature and Criteria for Diagnosis (6th ed). Boston, MA: Little Brown, 1964.
8. Hoeper MM, Bogaard HJ, Condliffe R, et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol 2013; 62(25 Suppl): D42-50.
9 . Palumbo A, Avet-Loiseau H, Oliva S, et al. Revised International Staging System for Multiple Myeloma: A Report From International Myeloma Working Group. J Clin Oncol 2015; 33:2863-9.
10. Task Force for Diagnosis and Treatment of Pulmonary Hypertension of European Society of Cardiology (ESC), European Respiratory Society (ERS), International Society of Heart and Lung Transplantation (ISHLT), et al. Guidelines for the diagnosis and treatment of pulmonary hypertension. Eur Resp J 2009; 34: 1219-63.
11. Simonneau G, Gatzoulis MA, Adatia I, et al. Updated clinical classification of pulmonary hypertension. J Am Col Cardiol 2013; 62(25 Suppl): D34-41.
12. Sangani RG, Butler M, Kirchner HL, Berger A, Stamm JA. Echocardiography-defined pulmonary hypertension in multiple myeloma: risk factors and impact on outcomes. South Med J 2016; 109: 282-9.
13. McLaughlin VV, McGoon MD. Pulmonary arterial hypertension. Circulation 2006; 114: 1417-31.
14. Kim NH, Delcroix M, Jenkins DP, et al. Chronic thromboembolic pulmonary hypertension. J Am Coll Cardiol 2013; 62(25 Suppl): D92-9.
15. Dingli D, Utz JP, Gertz MA. Pulmonary hypertension in patients with amyloidosis. Chest 2001; 120:1735-8.
16. Pongpeera T. Reversible pulmonary hypertension and isolated right heart failure associated with multiple myeloma. Chest 2013; 144: 155A.
