GUSTAVO J. DAQUARTI1, ALEJANDRO MERETTA1, MARIANA CORNELI1, JUAN P. COSTABEL2,
MIRTA DIEZ3, OSVALDO H. MASOLI1
1Sección Medicina Nuclear, Servicio de Diagnóstico por Imágenes, 2Centro de Miocardiopatías, 3Sección de Insuficiencia Cardíaca y Trasplante, Servicio de Cardiología Clínica, Instituto Cardiovascular de Buenos Aires (ICBA), Buenos Aires, Argentina
Resumen La amiloidosis cardíaca del subtipo transtirretina (ATTR) es una cardiopatía restrictiva que causa insuficiencia cardíaca en un número considerable de pacientes. Su identificación temprana permitiría brindar tratamientos específicos. Sin embargo, el diagnóstico de ATTR es complejo y requiere métodos invasivos.
Los fosfonatos marcados con 99mTecnecio han demostrado ser útiles para el diagnóstico, aunque en Argentina la experiencia es escasa. Nuestro objetivo fue evaluar la utilidad de este método para diagnosticar de forma no invasiva la ATTR. Se estudiaron 46 pacientes entre septiembre de 2016 y enero de 2018 por sospecha de amiloidosis cardíaca. Se evaluó el grado de captación cardíaca con relación al tejido óseo, a la hora, mediante dos métodos: semi-cuantitativo y cuantitativo. El diagnóstico definitivo de amiloidosis y el subtipo específico fue asignado por el centro de miocardiopatías de nuestra institución siguiendo recomendaciones internacionales.
Una captación ≥ grado II presentó un valor predictivo positivo del 96% y negativo del 100% para el diagnóstico de amiloidosis cardíaca ATTR. El valor de corte de 1.38 en la relación corazón/pulmón presentó una sensibilidad del 96% y una especificidad del 100% para discriminar entre pacientes con ATTR de aquellos con amiloidosis por cadenas livianas u otras afecciones (área bajo la curva relación corazón/pulmón = 0.95 p < 0.001). La centellografía con fosfonatos marcados demostró ser un método no invasivo útil para diagnosticar ATTR. Dado que además de ser no invasiva, es una herramienta de bajo costo y ampliamente disponible en nuestro medio, su aplicación puede redundar en un beneficio clínico para muchos pacientes.
Palabras clave: amiloidosis, cardiomiopatía restrictiva, centellografía
Abstract Bone seeking tracers´ scintigraphy for the diagnosis of transthyretin cardiac amyloidosis. Transthyretin cardiac amyloidosis (ATTR) is a restrictive cardiomyopathy that leads to heart failure in considerable number of patients. Early diagnosis allows specific treatment options. However, ATTR diagnosis is complex and requires invasive procedures. The utility of 99mTc-phosphate tracers for non-invasive diagnosis is well-known but the experience in Argentina is insufficient. The aim of this work was to assess the utility of 99mTc-phosphate tracers for the diagnosis of ATTR. A total of 46 scintigraphies for detection of cardiac amyloidosis performed between September 2016 and January 2018 were analyzed. Cardiac retention after one hour was assessed in relation to bone uptake using two methods: A semi-quantitative visual score (grade 0 = absent, I = low II = moderate-III = high) and a quantitative method (heart/lung ratio). The final diagnosis and the amyloidosis subtype were carried out by our institution cardiomyopathy team according to international guidelines.
The positive and negative predictive values for Grade ≥ II were 96% and 100% respectively for diagnosis of ATTR. Using 1.38 as cut-off value for heart/lung ratio the sensitivity and the specificity were 96% and 100%, respectively for differentiating transthyretin cardiac amyloidosis from light-chain cardiac amyloidosis and other cardiopathies. Scintigraphy with 99mTc-phosphate tracers enable noninvasive diagnosis and subtype classification of cardiac amyloidosis. The use of this non-invasive, inexpensive and widely available tool will result in better patient management.
Key words: amyloidosis, restrictive cardiomyopathy, scintigraphy
Dirección postal: Gustavo Javier Daquarti, Instituto Cardiovascular de
Buenos Aires, Blanco Encalada 1543, 1428 Buenos Aires, Argentina
e-mail: gdaquarti@icba.com.ar
La amiloidosis cardíaca por transtirretina (ATTR) es una miocardiopatía restrictiva caracterizada por el depó- sito anómalo de transtirretina en el intersticio cardiaco1.
Antiguamente considerada una enfermedad rara, hoy en día se le atribuye un número creciente de internaciones por insuficiencia cardíaca. Se estima que es responsable de >10% de los casos de insuficiencia cardíaca con fun- ción sistólica conservada2, y ese valor se eleva al 20% en pacientes añosos 3.
Recientemente nuevos fármacos específicos han mos- trado ser útiles para evitar la progresión de la enfermedad y reducir la mortalidad 4-6.
Sin embargo, el diagnóstico es complejo, ya que los métodos no invasivos como el electrocardiograma, la ecografía o la resonancia magnética son incapaces de diferenciar el subtipo transtirretina de otros subtipos de amiloidosis7. Es por esto que muchas veces es necesa- rio recurrir a la biopsia cardíaca8, una práctica invasiva, costosa, operador-dependiente y de baja disponibilidad en nuestro medio. Existe creciente evidencia que indica que es posible diagnosticar ATTR de forma no invasiva mediante el uso de fosfonatos marcados con Tecnecio 99 metaestable (Tc99m-fosfonatos)9. La centellografía cardíaca ofrecería un alto rédito diagnóstico. En Argen- tina, sin embargo, la experiencia de su uso es escasa. El objetivo de nuestro trabajo fue evaluar la utilidad de la centellografía con Tc99m-fosfonatos para el diagnóstico de ATTR de forma no invasiva.
Materiales y métodos
Fueron incluidos todos los pacientes a los que se les realizó una centellografía cardíaca con fosfonatos por sospecha de amiloidosis cardíaca entre septiembre 2016 y enero 2018 en el Instituto Cardiovascular de Buenos Aires. Fueron excluidos aquellos que no tenían seguimiento en nuestra institución.
La centellografía se realizó una hora después de inyectar de forma endovenosa 20 mCi de pirofosfato 99mTc (PYP- Tc99m) o 99mTc-hidroxi-metilendifosfonato (HDMP-Tc99m). Se adquirieron imágenes en una cámara ADAC doble cabezal bajo el siguiente protocolo: 1) Imágenes planares (anterior y oblicua anterior izquierda): Matrix 128×128 un millón de cuen- tas; 2) Imágenes tomográficas gatilladas (GATED SPECT): Matrix 64×64 con 30 segundos por cuadro. Las imágenes fue- ron procesadas con el software VEXWIN de Veccsa. El infor- me fue realizado de forma independiente por dos cardiólogos con experiencia en la evaluación de estudios de cardiología nuclear. Las discrepancias fueron resueltas por consenso. Se evaluó el grado de captación cardíaca en relación al tejido óseo mediante dos métodos10: 1) Semicuantitativo, siguiendo la escala visual de Perugini11, donde se comparó la captación cardíaca en relación al esternón: grado 0 = captación ausente, I = captación cardíaca menor que el esternón, II = captación cardíaca similar que el esternón, III = captación cardíaca ma- yor que el esternón. 2) Cuantitativo: relación corazón-pulmón definida como el número obtenido de dividir las cuentas a nivel de la silueta cardíaca y las cuentas en un área de igual tamaño situada contralateralmente (Fig. 1).
Basados en los resultados de los electrocardiogramas, eco- cardiogramas, valoración clínica, resonancia magnética, biopsias de tejido (cardíaco o grasa abdominal), se adjudicó el diagnóstico a cargo de un grupo de expertos en cardiopatías. Se solicitó test genético para ATTR en aquellos pacientes con alta sospecha diagnóstica cuando los métodos anteriores no fueron concluyen- tes. Se definió ATTR cuando presentaban imágenes ecográficas y/o de resonancia cardíaca sugerentes de amiloidosis con al menos una de las siguientes características: biopsia de tejido con marcación positiva para rojo Congo y ausencia de marcación para cadenas kappa o lambda por inmunohistoquímica; biopsia de tejido con marcación positiva para rojo Congo con inmunofija- ción en sangre y orina negativas y ausencia de cadenas livianas kappa y lambda en sangre; test genético positivo para TTR.
Las imágenes sugerentes de amiloidosis fueron definidas por presentar al menos tres de las siguientes características: engrosamiento septal >13 mm; dilatación biauricular; engrosamiento interauricular o valvar; patrón granular ecográfico en el septum interventricular; realce tardío de gadolinio con patrón subendocárdico difuso en la resonancia cardíaca. Se definió disfunción ventricular derecha como la presencia de una excursión sistólica del anillo tricúspideo (TAPSE) < 17 mm en el ecocardiograma12.
Las variables categóricas fueron presentadas como por- centajes y las continuas como medianas con su corres- pondiente intervalo intercuartilo. Para su comparación se utilizaron los test de chi cuadrado o Fisher y Mann-Whitney, respectivamente. Se calculó el valor predictivo positivo (VPP) y el valor predictivo negativo (VPN) para el diagnóstico de ATTR en la población estudiada. Se averiguó la sensibilidad y la especificidad de la relación pulmón-contralateral para el diagnóstico de ATTR mediante el análisis de la característi- ca operativa del receptor (Curva ROC). Todas las hipótesis fueron testeadas a dos colas y se consideró significativa una p < 0.05. El análisis de datos fue realizado mediante SPSS para Windows 20.0 (SPSS Inc, Chicago, Ill).
El estudio fue desarrollado según los principios de la Declaración de Helsinki y aprobado por el comité de docencia e investigación de la institución y por un comité de ética indepen- diente. Todos los pacientes firmaron consentimiento informado.
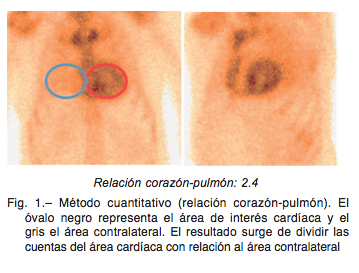
Resultados
Se analizaron 46 pacientes (67% hombres, 77 años ± 11). Treinta y uno fueron diagnosticados con amiloidosis car- díaca y 15 con otras afecciones (5 por miocardiopatía hipertrófica, 5 por valvulopatías, 3 por cardiopatía isqué- mica y 2 por miocardiopatía idiopática). La amiloidosis fue interpretada como ATTR en 26 pacientes (84%) y asociada a cadenas livianas en 5 (16%).
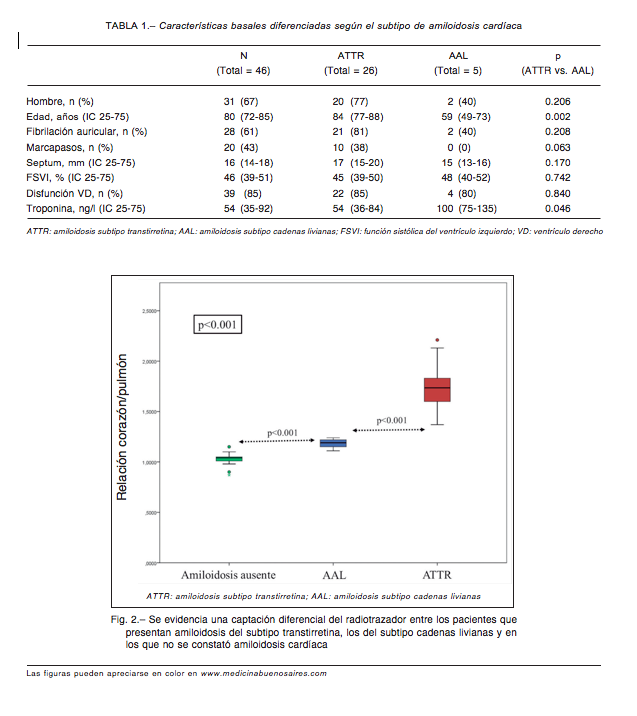
Los pacientes con ATTR eran más añosos (p = 0.002). Presentaban un mayor grado de hipertrofia septal (17 mm vs. 15 mm) y menores niveles de troponina basal (54 ng/l vs. 100 ng/l) que aquellos con amiloidosis del subtipo cadenas livianas, aunque estas diferencias no resultaron significativas (Tabla 1).
Según la evaluación semicuantitativa, los pacientes se distribuyeron de la siguiente manera: captación grado 0: 8; captación grado I: 12; captación grado II: 5; captación grado III: 21. La captación ≥ grado II en nuestro estudio presentó un VPP del 96% y VPN del 100% para el diagnóstico de ATTR. Se evidenció una captación diferencial del radiotrazador entre los pacientes con ATTR, AAL y aquellos con otras enfermedades (Fig. 2). La relación corazón/pulmón demostró tener performance excelente para el diagnóstico de ATTR vs. pacientes con AAL y otras afecciones (área bajo la curva = 0.95, p < 0.001). El valor de corte de 1.38 relación corazón/pulmón presentó una sensibilidad del 96% y una especificidad del 100% en el análisis de curva ROC
Discusión
La diferenciación del subtipo de amiloidosis permite orientar el pronóstico y es fundamental para guiar el tra- tamiento3, 8. La ATTR debe diferenciarse principalmente de del subtipo cadenas livianas (AAL), relacionado con una discrasia sanguínea y caracterizado por el depósi- to de cadenas livianas de inmunoglobulinas (Kappa y Lambda) debido a una sobreproducción a nivel plasmo-
citario1. Nuestro trabajo agrega evidencia sobre la utilidad diagnóstica de la centellografía con fosfonatos para el diagnóstico de ATTR en nuestro país. En un estudio multicéntrico de más de 1200 pacientes, Gilmore y col.9 observaron una excelente correla- ción entre la centellografía y el diagnóstico de ATTR mediante biopsia cardíaca. En nuestro estudio hemos utilizado 99mTc-hidroximetilen-difosfonato (HMDP) y piro- fosfato (PYP). Ambos, junto con el tecnecio difosfonato (99mTc-DPD), han demostrado tener un excelente rédito diagnóstico para ATTR en publicaciones recientes9, 13. El 99mTc-metilendifosfonato (99mTc-MDP), ampliamente disponible en Argentina, no estaría recomendado debido a su menor sensibilidad diagnóstica14. La explicación fisiopatológica de la utilidad de los fosfonatos radica en que el depósito amiloide estaría compuesto por mate- rial proteico dispuesto alrededor de un centro cálcico. Existiendo diferencia entre el contenido cálcico de la amiloidosis subtipo cadenas livianas (AAL) y la ATTR, el fosfonato permitiría realizar el diagnóstico diferencial entre ambos subtipos14.
La ATTR es una enfermedad que muchas veces pasa oculta tras el diagnóstico erróneo de miocardiopatía hiper- trófica15 o miocardiopatía valvular aórtica16. Identificarla es importante para el tratamiento. Sin embargo, los métodos invasivos, considerados como estándar diagnóstico, suelen evitarse ya que se trata de una población añosa y con múltiples comorbilidades17.
Podemos concluir que la centellografía con fosfonatos es un método de suma utilidad para el diagnóstico y tipifi- cación de la amiloidosis cardíaca. Siendo una herramienta no invasiva, de bajo costo y de alta disponibilidad en nues- tro medio, creemos que incrementar su uso redundará en un beneficio clínico para muchos casos.
Como limitaciones señalamos que los pacientes referidos a la centellografía fueron seleccionados por presentar alta sospecha clínica e imagenológica de amiloidosis cardíaca. Así mismo es importante destacar que los mé- dicos que asignaron el diagnóstico podrían haber tenido conocimiento del resultado de la centellografía y esto podría haber influido en el diagnóstico final. Sin embargo, consideramos esto poco relevante, ya que el diagnóstico de ATTR se fundamentó en los informes de patólogos, bioquímicos y genetistas que no tenían conocimiento del resultado del estudio de medicina nuclear.
Agradecimientos: El trabajo no podría haber sido llevado a cabo sin la extensa colaboración del equipo de Medicina Nuclear, con especial mención a los señores técnicos Néstor Blanco y Diego Coronel.
Conflicto de intereses: Ninguno para declarar
Bibliografía
- Banypersad SM, Moon JC, Whelan C, Hawkins PN, Wechalekar AD. Updates in cardiac amyloidosis: a re- view. J Am Heart Assoc 2012; 1:e000364.
- González-López E, Gallego-Delgado M, Guzzo-Merello G, et al. Wild-type transthyretin amyloidosis as a cause of heart failure with preserved ejection fraction. Eur Heart J 2015; 36: 2585-94.
- Maurer MS, Elliott P, Comenzo R, Semigran M, Rapezzi C. Addressing common questions encountered in the diagnosis and management of cardiac amyloidosis. Cir– culation 2017;135: 1357-1377.
- 4. Bordeneuve VP, Barroso FA, Merlini G, et al. Inotersen treatment for patients with hereditary transthyretin amy loidosis. N Engl J Med 2018; 379: 22-31.
- Gundapaneni B, Elliott PM, Huber P, et al. Tafamidis treatment for patients with transthyretin amyloid cardio- myopathy. N Engl J Med 2018; 379: 1007-16.
- Adams D, Gonzalez-Duarte AG, O’Riordan WD, et al. Pa- tisiran, an RNAi therapeutic, for hereditary transthyretin amyloidosis. N Engl J Med 2018; 379: 11-21.
- Martinez-Naharro A, Treibel TA, Abdel-Gadir A, et al. Magnetic resonance in transthyretin cardiac amyloidosis. J Am Coll Cardiol 2017;70: 466-77.
- Izumiya Y, Takashio S, Oda S, Yamashita Y, Tsujita K. Recent advances in diagnosis and treatment of cardiac amyloidosis. J Cardiol 2017; 71: 135-43.
- Gillmore JD, Maurer MS, Falk RH, et al. Nonbiopsy diagnosis of cardiac transthyretin amyloidosis. Circulation 2016; 133: 2404-12.
- Bokhari S, Morgenstern R, Weinberg R. Standardization of 99m technetium pyrophosphate imaging methodology to diagnose TTR cardiac amyloidosis. J Nucl Cardiol 2018; 25: 181-90.
- Perugini E, Guidalotti PL, Salvi F, et al. Noninvasive etio- logic diagnosis of cardiac amyloidosis using 99mTc-3,3- diphosphono-1,2-propanodicarboxylic acid scintigraphy. J Am Coll Cardiol 2005; 46: 1076-84.
- Arvidsson S, Henein MY, Wikström G, Suhr OB. Right ventricular involvement in transthyretin amyloidosis. Amyloid 2018; 0: 1-7.
- 13. Galat A, Rosso J, Guellich A, et al. Usefulness of (99m) Tc-HMDP scintigraphy for the etiologic diagnosis and prognosis of cardiac Amyloid 2015; 22: 210-20.
- Rapezzi C, Gagliardi C, Milandri A. Analogies and dispari- ties among scintigraphic bone tracers in the diagnosis of cardiac and non-cardiac ATTR amyloidosis. J Nucl Cardiol 2018. doi: 10.1007/s12350-018-1235-6. [Epub ahead of print]
- Cortes MM, Battioni L, Sciancalepore A, Costabel Amiloidosis cardíaca simulando una miocardiopatía hipertrófica. Rev Fed Argentina Cardiol 2015; 44: 229-32.
- Castaño A, Narotsky DL, Hamid N, et al. Unveiling trans- thyretin cardiac amyloidosis and its predictors among elderly patients with severe aortic stenosis undergoing transcatheter aortic valve replacement. Eur Heart J 2017;38: 2879-87.
- Papoutsidakis N, Miller EJ, Rodonski A, Jacoby D. Time course of common clinical manifestations in patients with transthyretin cardiac amyloidosis: Delay from symptom onset to diagnosis. J Card Fail 2018; 24: 131-3.
