GUILLERMO R. PROZZI1, 2, MARTÍN CAÑÁS1-3, MARTÍN A. URTASUN1-3, HÉCTOR O. BUSCHIAZZO1, 3,
CRISTIAN M. DORATI1, PERLA MORDUJOVICH-BUSCHIAZZO1
1Centro Universitario de Farmacología, Facultad de Ciencias Médicas, Universidad Nacional de La Plata, Centro colaborador para el uso racional de los medicamentos OMS/OPS, 2Instituto de Ciencias de la Salud, Universidad Nacional Arturo Jauretche, 3Federación Médica de la Provincia de Buenos Aires
Resumen Los antiinflamatorios no esteroideos (AINEs) se encuentran entre los fármacos más utilizados en la práctica clínica. Actúan mediante el bloqueo de las enzimas ciclooxigenasas (COX), pero el grado de inhibición de COX-1 y COX-2 varía entre ellos. Se ha generalizado la clasificación entre COX-2 selectivos o coxibs, y los no selectivos o AINEs tradicionales. Tanto los efectos analgésico y antiinflamatorio como los efectos adversos cardiovasculares dependen de la inhibición de COX-2. Este trabajo revisa las evidencias disponibles del aumento del riesgo de eventos trombóticos tanto para los coxibs como para los AINEs tradicionales. El efecto protrombótico podría deberse a la inhibición de la COX-2 endotelial, con disminución de la prostaciclina y un incremento relativo de los niveles del tromboxano plaquetario. Los coxibs y el diclofenac, 150 mg/día, aumentarían el riesgo de eventos vasculares mayores en más de un tercio. El ibuprofeno 2400 mg/día aumentaría levemente el riesgo de eventos coronarios. El naproxeno 1000 mg/día no incrementaría el riesgo de eventos vasculares. Además, el ibuprofeno y el naproxeno tienen el potencial del disminuir el efecto cardioprotector de bajas dosis de aspirina. El naproxeno (≤ 1000 mg/día) y el ibuprofeno a bajas dosis (≤ 1200 mg/día) deberían considerarse los AINEs con el mejor perfil de seguridad cardiovascular. Las decisiones terapéuticas deben basarse en una adecuada evaluación del riesgo del paciente, utilizando los AINEs más seguros, a las menores dosis efectivas, por el menor tiempo posible que permita el control de los síntomas, restringiendo su utilización en enfermos con aumento del riesgo cardiovascular.
Palabras clave: antiinflamatorios no esteroideos, inhibidores de la ciclooxigenasa 2, diclofenaco, ibuprofeno, naproxeno, enfermedades cardiovasculares
Abstract Cardiovascular risk of non-steroidal anti-inflammatory drugs. Non-steroidal anti-inflammatories (NSAIDs) are among the most commonly used drugs in clinical practice. They block cyclooxygenases (COX) enzymes, but the degree of inhibition of COX-1 and COX-2 varies between them. In general, NSAIDs are classified in selective COX-2 or coxibs and non-selective or traditional NSAIDs. Both the analgesic and anti-inflammatory effects, as well as the cardiovascular adverse effects, depend on the COX-2 inhibition. This paper reviews the available evidence of the increased risk of thrombotic events for both coxibs and traditional NSAID. The prothrombotic effect could be due to the inhibition of endothelial COX-2, with a decrease in production of prostacyclin and a relative increase in platelet thromboxane levels. Coxibs and diclofenac 150 mg/day seem to increase the risk of major vascular events by more than a third. Ibuprofen 2400 mg/day could slightly increase the risk of coronary events. Naproxen 1000 mg/day apparently does not increase the risk of vascular events. Besides ibuprofen and naproxen have the potential to decrease the cardioprotective effect of low doses of aspirin. Naproxen (≤ 1000 mg/day) and low doses of ibuprofen (≤ 1200 mg/day) are considered to have the most favorable thrombotic cardiovascular safety profiles of all NSAIDs. Therapeutic decisions should be based on an assessment of a person´s individual risk factors, using the safest NSAIDs, at the lowest effective doses, for the shortest duration necessary to control symptoms, restricting their use in patients with increased cardiovascular risk.
Key words: anti-inflammatory agents, non-steroidal, cyclooxygenase 2 inhibitors, diclofenac, ibuprofen, naproxen, cardiovascular disease
Recibido: 12-VI-2018 Aceptado: 23-VIII-2018
Dirección postal: Guillermo R. Prozzi, Centro Universitario de Farmacología, Hospital Elina de la Serna de Montes de Oca, Calle 8 N° 483, 1900 La Plata, Argentina
e-mail: grprozzi@gmail.com
Los antiinflamatorios no esteroideos (AINEs) son medicamentos que están indicados para el alivio de cuadros de dolor e inflamación agudos y crónicos, y se encuentran entre los fármacos más utilizados, tanto por prescripción médica, como por automedicación1. Se estima que 30 millones de pacientes los utilizan diariamente en todo el mundo2. En el año 2012, se vendieron en Argentina a nivel ambulatorio, alrededor de 70 millones de unidades de ibuprofeno, diclofenac, meloxicam, naproxeno, ketorolac e inhibidores selectivos de la ciclooxigenasa 2. (IMS Health Argentina, comunicación personal).
Desde la introducción de la aspirina en 1897, se han comercializado más de 50 AINEs. Todos bloquean a las enzimas ciclooxigenasas (COX) pero el grado de inhibición de cada una de ellas; COX-1 y COX-2, varía entre los miembros del grupo3. Esto ha popularizado la clasificación de los AINEs entre, los selectivos COX-2 o coxibs y los no selectivos o AINEs tradicionales (AINEsT).
Los efectos analgésico y antiinflamatorio de todos los AINEs dependen de la inhibición COX-2 y no están relacionados con la selectividad por la enzima. Algunos de sus efectos adversos, principalmente los cardiovasculares (CV) y renales dependen también del bloqueo de la COX-2, posiblemente en forma dosis dependiente.
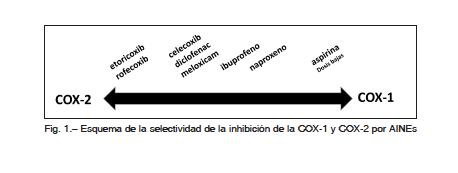
El grado de inhibición de la COX-1 es variable entre los AINEs, siendo menor con los que presentan mayor selectividad COX-2. Sin embargo, a medida que se incrementa la dosis, tanto de los selectivos como de los no selectivos, aumenta la inhibición de la COX-1. Los efectos adversos gastrointestinales (GI) dependen principalmente del bloqueo de ésta última. La aspirina es el único miembro del grupo que en dosis bajas logra una marcada inhibición de la COX-1 plaquetaria. Es útil considerar la inhibición COX-1 y COX-2 como un continuo, donde cada AINE ocupará un lugar dependiendo de su selectividad y dosis utilizada (Fig. 1).
Las revisiones sistemáticas de ensayos clínicos controlados, realizados en cuadros de dolor agudo y crónico, muestran que no existen importantes diferencias de eficacia analgésica entre los miembros del grupo4, 5. En general, es ampliamente aceptado que el efecto analgésico es similar para todos los AINEs y las guías de práctica clínica para el manejo del dolor suelen dejar a criterio del médico la selección del AINE a utilizar7, 8.
El uso de los AINEs se asocia a una amplia variedad de efectos adversos, siendo los GI los que más preocuparon durante décadas a los prescriptores y a la comunidad, debido a su frecuencia y gravedad9. Pero, desde la aparición del rofecoxib, numerosas evidencias muestran que los AINEs, (excepto la aspirina) se asocian también a un aumento del riesgo de eventos trombóticos arteriales10-12. Dado que son fármacos tan utilizados, incluso los pequeños aumentos de riesgo cardiovascular (RCV) pueden tener impacto negativo en la salud pública, lo que debe llevar a prestar especial atención a su seguridad.
La última década de investigación ha aportado información relevante sobre el perfil de toxicidad CV de los AINEs, que creemos de utilidad revisar con el propósito de brindar recomendaciones para una práctica clínica más segura.
Riesgo cardiovascular de los AINEs
Desde los años 70 existen informes que relacionan a los AINEs con un aumento en los valores de presión arterial13 y casos de insuficiencia cardíaca14. Varios estudios posteriores confirman ambas asociaciones12,15,16. A partir del 2000, con la utilización de los coxibs, se han acumulado evidencias del riesgo de eventos trombóticos graves, como infarto agudo de miocardio (IAM) y accidentes cerebro vasculares (ACV)17, 18. En un principio se pensó que el aumento del riesgo de eventos trombóticos era propio de los inhibidores selectivos COX-2, sin embargo, importantes metaanálisis de ensayos clínicos10,12 mostraron que también se observa con los AINEs tradicionales. Además, otros metaanálisis de estudios observacionales han asociado la utilización de los AINEs con arritmias19.
Algunos estudios han analizado los mecanismos y magnitud del riesgo trombótico asociado al uso de AINEs, tratando de caracterizar los factores que lo determinan: selectividad COX-2, dosis, duración de uso y RCV basal del paciente12,20.
Aumento de la presión arterial y riesgo de insuficiencia cardíaca
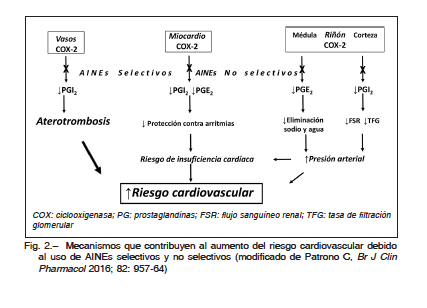
Los AINEs (selectivos y no selectivos) se asocian con un incremento del riesgo de hipertensión arterial (HTA) e insuficiencia cardíaca (IC). El mecanismo implica la retención de sodio y la vasoconstricción, debidas principalmente a la inhibición de la COX-2 de riñones y vasos, con disminución de los niveles de las prostaglandinas E2 (PGE2) e I2 (PGI2). A nivel de la médula renal la diminución de la PGE2 se relaciona con retención de sodio y agua. A nivel de la corteza renal la disminución de PGI2 se asocia con disminución del flujo sanguíneo renal y de la tasa de filtrado glomerular. Otro mecanismo propuesto que podría contribuir al incremento de riesgo de IC es que la inhibición de la COX-2 en los cardiomiocitos (con caída de PGE2 y PGI2) disminuiría la protección contra la injuria oxidativa y las arritmias. Todos los AINEs selectivos y no selectivos inhiben la COX-220 (Fig. 2).
El mayor metaanálisis de ensayos clínicos controlados muestra que el uso prolongado de AINEs, independientemente de su selectividad, aumenta al doble el riesgo de hospitalización debido a IC12.
En pacientes tratados por HTA que reciben AINEs se puede observar un aumento de hasta 5 a 6 mmHg en los valores de la presión arterial media. Este aumento sufre amplias variaciones dependiendo de la edad del paciente, el AINE y el antihipertensivo utilizado. Incluso, en pacientes normotensos se ha observado un pequeño aumento de los valores de presión arterial21, 22.
Faltan datos para determinar cuál es la fracción del riesgo atribuible a la HTA por AINEs sobre la totalidad del incremento del RCV, aunque ese riesgo aumentaría con exposiciones prolongadas y dosis altas23.
Mecanismo protrombótico
El endotelio vascular y las plaquetas tienen un rol importante en la regulación de la homeostasis vascular y fenómenos trombóticos. En el endotelio vascular se expresan ambas isoenzimas (COX-1 y COX-2) responsables de la síntesis de PGI2, con efecto vasodilatador, inhibidor de la agregación plaquetaria y acción antitrombótica. Las plaquetas solo expresan la COX-1, responsable de la producción del tromboxano (TXA2) que aumenta la vasoconstricción, la agregación plaquetaria y la remodelación vascular y cardíaca. Es muy probable que el aumento de los procesos trombóticos provocado por los AINEs se deba en gran medida a la inhibición de la COX-2 endotelial, con disminución de la PGI2 (Fig. 2) y un incremento relativo de los niveles de TXA224.
De esta forma, el perfil de RCV de cada AINE podría depender de la alteración relativa en los niveles de PGI2 endotelial y TXA2 plaquetario. Esto estaría determinado por el grado de selectividad COX-2 de cada fármaco; sin embargo, la dosis administrada, el tiempo de uso y el nivel basal de riesgo de cada paciente, también contribuirían.
Debemos recordar que la aspirina en dosis de 30 a 1500 mg/día es el único AINE que ha demostrado consistentemente en estudios clínicos proteger de eventos CV, posiblemente debido a su mayor capacidad de inhibir la COX-1 y la agregación plaquetaria, sin afectar marcadamente la COX-2 endotelial25.
Principales evidencias clínicas
En el año 2000, el estudio VIGOR (Vioxx Gastrointestinal Outcomes Research) mostró por primera vez el aumento
significativo del riesgo de IAM por el rofecoxib comparado con el naproxeno (0.4% vs. 0.1% respectivamente)17. Los autores sostuvieron que los resultados observados no eran debidos a que el rofecoxib incrementaba el riesgo, sino a un efecto protector (símil aspirina) del naproxeno.
En el año 2005, dos ensayos clínicos de coxibs contra placebo para la prevención de adenomas colónicos, uno con rofecoxib26 y otro con celecoxib27 mostraron nuevamente un aumento del riesgo de eventos trombóticos. En el primer estudio el grupo que recibió rofecoxib presentó casi el doble de riesgo que el grupo placebo. Estos nuevos datos, sumados a los del estudio VIGOR, condujeron a la suspensión del ensayo clínico, y al retiro voluntario del rofecoxib a nivel mundial por la compañía farmacéutica. El segundo estudio con celecoxib también debió suspenderse antes del tiempo establecido en el protocolo, debido a que en una variable compuesta (muerte de causa CV, IAM, ACV e IC) los grupos que recibieron 800 mg/día, 400 mg/día y placebo presentaron 3.4%, 2.3% y 1.0% de eventos, respectivamente27.
Estos dos ensayos clínicos mostraron que dos coxibs estructuralmente no relacionados, se asocian a un aumento del riesgo de eventos trombóticos. Además, el estudio con celecoxib sugirió un efecto dosis dependiente.
En 2006, se publicó un metaanálisis de ensayos clínicos controlados que demostró que los AINEs tradicionales también pueden aumentar el riesgo de eventos CV graves. Los autores concluyeron que los inhibidores selectivos COX-2, al igual que altas dosis de diclofenac y posiblemente ibuprofeno, aumentan moderadamente el riesgo de eventos vasculares. Sin embargo, altas dosis (1000 mg/día) de naproxeno no se asociaron a tal exceso de riesgo10.
Es interesante observar cómo, con las mismas evidencias disponibles, la Agencia Europea de Medicamentos (EMA, por su sigla en inglés) y la Administración de Alimentos y Drogas (FDA) de EE.UU., tomaron diferentes medidas regulatorias. La EMA decidió contraindicar los coxibs en pacientes con enfermedad coronaria o ACV y advertir sobre su utilización en pacientes con factores de RCV28, pero no incluyó a los AINEs tradicionales en la recomendación. Recién en el 2013, impuso las mismas restricciones al diclofenac29 y en el 2015, a las dosis altas de ibuprofeno30. La FDA ya había decidido en 2005 un cambio en los prospectos de todos los AINEs (excepto la aspirina) advirtiendo sobre el RCV, por considerarlo un efecto de clase31.
En 2011, un metaanálisis en red de ensayos clínicos controlados aleatorizados de gran escala mostró que el naproxeno estaba asociado a menor RCV que los coxibs, el diclofenac o el ibuprofeno32.
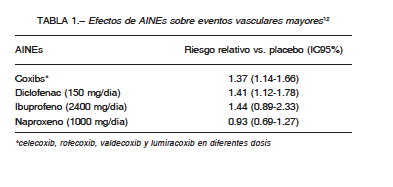
En el año 2013, se publicó el estudio Coxib and traditional NSAID Trialists’ Collaboration (CNT), el mayor metaanálisis de ensayos clínicos que analizó los datos individuales de los participantes12, brindando sólida evidencia. Este estudio mostró que el diclofenac en dosis de 150 mg/día, y los coxibs en conjunto (celecoxib, rofecoxib, etoricoxib y lumiracoxib), incrementan el riesgo de eventos vasculares mayores (IAM y ACV no fatal o muerte de causa vascular) en más de un tercio, debido principalmente al aumento del IAM no fatal. Con el ibuprofeno el riesgo fue similar pero no estadísticamente significativo (Tabla 1). Sin embargo, en las dosis analizadas (2400 mg/día), el ibuprofeno incrementó significativamente el número de eventos coronarios. Por otra parte, el naproxeno (1000 mg/día) fue el único que no incrementó el riesgo de eventos vasculares mayores. El riesgo de muerte aumentó significativamente con el diclofenac y los coxibs, pero no con el naproxeno.
Este metaanálisis12 muestra que el riesgo vascular de los coxibs aumenta en forma dosis dependiente, apoyando la hipótesis de que cuanto mayor es el grado de inhibición de la COX-2, mayor es el riesgo. El celecoxib en dosis de 200 mg/día parece tener un riesgo similar al placebo, aunque el resultado tiene una gran imprecisión (amplio intervalo de confianza del 95%).
La mayoría de los pacientes estudiados en el CNT presentaban un RCV basal bajo y en ellos el incremento absoluto del riesgo fue pequeño pero relevante clínicamente. Se estima que administrar un coxib o diclofenac (150 mg/día) en lugar de placebo causa 3 eventos CV adicionales por cada 1000 pacientes/año, principalmente IAM, y uno de ellos mortal. En pacientes con RCV basal alto se ha calculado que recibir un coxib o diclofenac en
lugar de placebo provocaría de 7 a 8 eventos adicionales, dos de ellos mortales12.
Por pedido de la EMA y de la FDA fueron diseñados dos ensayos clínicos, con el objetivo principal de evaluar el RCV del celecoxib comparado con los AINEsT.
En el estudio SCOT33 (The Standard Care vs. Celecoxib Outcome Trial) pacientes sin diagnóstico de enfermedad CV, con 60 años o más, la mayoría con osteoartritis (OA), que recibían AINEsT en forma crónica, fueron aleatorizados a cambiar por celecoxib o continuar con el tratamiento previo. Los eventos CV fueron infrecuentes y similares en ambos grupos.
En la parte de este estudio efectuada en Escocia, donde todos los datos estuvieron disponibles, las dosis medias diarias de AINEs utilizadas fueron: 170 mg de celecoxib, 79 mg de diclofenac, 676 mg de ibuprofeno y 581 mg de naproxeno, la mayoría de ellas muy por debajo de las dosis diarias analizadas en el CNT (diclofenac:150 mg, ibuprofeno 2400 mg y naproxeno 1000 mg).
Debido a las debilidades metodológicos del estudio, entre ellas, el limitado poder estadístico (pocos eventos en ambos grupos), las diferencias en las tasas de retiro de los pacientes (mayor en el grupo celecoxib) y las dosis bajas comparadas, no se pueden establecer conclusiones.
El ensayo PRECISION34 (Prospective Evaluation of Celecoxib Integrated Safety versus Ibuprofen or Naproxen) al igual que el SCOT, fue un estudio de no inferioridad que evaluó la seguridad CV del celecoxib en pacientes de mayor riesgo cardíaco. Incluyó más de 24 000 pacientes, la mayoría de ellos con OA. Sin embargo, presenta limitaciones y observaciones metodológicas que no permiten establecer conclusiones definitivas35, 36, no agrega información relevante al CNT y posiblemente no modifique la práctica clínica. En primer lugar, no se logró el objetivo inicial de evaluar pacientes con alto RCV, ya que en el estudio solo se registraron aproximadamente 1% de eventos CV por año. En segundo lugar, un porcentaje importante de los participantes recibían dosis bajas de aspirina, lo que pudo generar un sesgo en favor del celecoxib, ya que el efecto cardioprotector del ácido acetilsalicílico podría ser disminuido por el ibuprofeno y el naproxeno, pero no por el celecoxib, que a diferencia de los AINEsT, presenta escasa capacidad de inhibir competitivamente la unión de la aspirina a la COX-1 plaquetaria y su consecuente efecto antiagregante. En tercer lugar, el poder estadístico del estudio fue 80%, lo que hace difícil poder establecer la no inferioridad del celecoxib con un riesgo relativo (RR) de 1.37 (riesgo observado en el CNT). En cuarto lugar, un porcentaje alto de los participantes (más del 60%) abandonó el tratamiento al que habían sido asignados.
Los resultados del ensayo mostraron que el celecoxib, en dosis promedio de 209 mg/día, no es inferior a naproxeno 852 mg/día, o al ibuprofeno 2045 mg/día, con respecto a una variable compuesta por muerte de causa CV e IAM y ACV no fatales. Las bajas dosis de celecoxib utilizadas plantean la duda de si las dosis comparadas fueron equivalentes. Es conocido que menores dosis de AINEs se correlacionan con menor eficacia analgésica y menores efectos adversos CV, renales, GI y viceversa. Es posible que la dosis de celecoxib no haya sido equivalente ya que con los AINEsT se observó mayor respuesta analgésica, hipertensión y efectos renales, posiblemente debido a mayor inhibición de la COX-2.
Analizando estos resultados, en abril de 2018, un panel asesor de la FDA no realizó modificaciones sustanciales a la advertencia previa sobre el RCV, común a todos los AINEs. Pero no considera en su análisis las bajas dosis de celecoxib utilizadas en el estudio PRECISION37.
Al igual que otros autores38 creemos que los resultados del estudio PRECISION no se contraponen a la información previamente aportada por el CNT sobre el RCV de los coxibs y AINEs tradicionales. La menor inhibición de la COX-2, debido a las bajas dosis de celecoxib utilizadas en ese estudio, explicaría la poca o ninguna diferencia de riesgo de éste con los AINEsT.
El metaanálisis de Kearney y col.10 y el CNT12, sugieren que 1000 mg/día de naproxeno no aumentarían significativamente el riesgo de eventos vasculares mayores. Desde entonces, algunas guías de práctica clínica39 recomiendan al naproxeno como el AINE más seguro en pacientes con incremento del RCV.
Posiblemente, las altas dosis de naproxeno utilizadas, su larga vida media y una mayor selectividad por la COX-1, logran una disminución de la actividad del tromboxano y de la agregación plaquetaria, similar a la aspirina, que balancea el riesgo de la inhibición COX-2. Aunque los datos son escasos para establecer conclusiones definitivas, para Patrono y col20, con dosis menores de naproxeno (440 mg/día) no es esperable una inhibición suficiente de la COX-1, ni el efecto antiplaquetario visto con la dosis de 1000 mg/día. Esto plantea la pregunta de ¿cuál es la menor dosis segura cardiovascular de naproxeno? Con las evidencias disponibles no tenemos una respuesta definitiva.
Una revisión realizada por expertos de la EMA40 sostiene que el ibuprofeno en dosis de 1200 mg/día no incrementa el riesgo de eventos trombóticos. El CNT muestra que con dosis de 2400 mg/día existe un pequeño incremento de dicho riesgo. Desconocemos como es el incremento del riesgo con las dosis intermedias, entre 1200 y 2400 mg/día.
La Agencia Británica de Medicamentos sostiene que el naproxeno y el ibuprofeno en dosis bajas, deberían considerarse los AINEs con el mejor perfil de seguridad CV41, y el National Institute for Health and Care Excellence (NICE) del Reino Unido promueve la utilización de ibuprofeno (1200 mg/día o menos), y de naproxeno (1000 mg/ día o menos) como los AINEs más seguros42.
Interacción entre AINEs y aspirina
Las interacciones farmacológicas entre algunos AINEs y las dosis bajas de aspirina podrían disminuir su efecto cardioprotector. Estudios realizados in vivo, ex vivo e in vitro muestran que el efecto antiplaquetario de la aspirina puede ser marcadamente inhibido por el ibuprofeno y el naproxeno dependiendo de la dosis y el tiempo de exposición. Los coxibs y el diclofenac no interfieren con el efecto antiagregante de la aspirina20, 43, 44. Se desconoce la relevancia que estos hallazgos podrían tener en la práctica diaria, debido a que ningún estudio clínico controlado ha sido diseñado para evaluar los efectos de esta interacción. En el estudio PRECISION34 donde 46% de los participantes utilizaban aspirina juntamente con ibuprofeno o naproxeno, no se encontró una interacción estadísticamente significativa. Aunque los datos disponibles no parecen apoyar una interacción clínicamente relevante, es posible que dosis elevadas, por tiempo prolongado, reduzcan el efecto cardioprotector de la aspirina. Algunos autores sostienen que administrar la aspirina 2 horas antes del naproxeno podría disminuir la posible interacción45 y con igual objetivo, la FDA recomienda ingerir el ibuprofeno al menos 30 minutos después u 8 horas antes de recibir la aspirina46.
En conclusión, las evidencias disponibles indican que tanto los AINEs selectivos COX-2 como los tradicionales pueden asociarse a un incremento del riesgo de eventos CV.
La información disponible es insuficiente para establecer en forma concluyente el riesgo propio de cada miembro del grupo.
El aumento del riesgo parece tener relación con la selectividad COX-2 y el grado de inhibición de la enzima. Las mayores dosis utilizadas se correlacionan con más inhibición de la COX-2 y posiblemente con mayor RCV (excepto para el naproxeno). Esta relación dosis dependiente está especialmente aceptada con los coxibs, ya que han sido evaluados a diferentes dosis en grandes ensayos clínicos controlados. Para la mayoría de los otros AINEs se carece de estudios controlados con suficiente poder estadístico que evalúen el rango de las dosis utilizadas en la práctica habitual. Los coxibs en conjunto (con la posible excepción del celecoxib 200 mg/día) se asocian a un incremento del riesgo de eventos trombóticos arteriales, al igual que el diclofenac e ibuprofeno en dosis de 150 y 2400 mg/ día, respectivamente. Es más incierto cuál podría ser el riesgo con la utilización de dosis menores de diclofenac. El naproxeno en dosis de 1000 mg/día y el ibuprofeno en dosis de 1200 mg/día no aumentarían el RCV.
Existe una relación directa entre el RCV basal del paciente y la frecuencia de eventos trombóticos.
El ibuprofeno y el naproxeno tienen el potencial de disminuir el efecto cardioprotector de la aspirina.
Con el fin de mitigar los efectos adversos CV de los AINEs, las decisiones terapéuticas deben basarse en una adecuada evaluación del riesgo individual del paciente, utilizando los AINEs más seguros, a las menores dosis efectivas, por el menor tiempo posible que permita el control de los síntomas, y restringiendo su utilización en pacientes con aumento del riesgo cardiovascular.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Conaghan PG. A turbulent decade for NSAIDs: update on current concepts of classification, epidemiology, comparative efficacy, and toxicity. Rheumatol Int 2012; 32: 1491-1502.
2. Singh G. Gastrointestinal complications of prescription and over the-counter nonsteroidal anti-inflammatory drugs: a view from the ARAMIS database: arthritis, rheumatism, and aging medical information system. Am J Ther 2000; 7: 115-21.
3. Grosser T, Smyth EM, Fitzgerald GA. Pharmacotherapy of inflammation, fever, pain and gout. En: Brunton LL, Hilal- Dandan R, Knollman BC eds. Goodman and Gilman´s The Pharmacological Basis of Therapeutics. Thirteenth edition. New York: Mc-Graw Hill Medical 2018, p 685-710.
4. Moore RA, Derry S, Aldington D, Wiffen PJ. Single dose oral analgesics for acute postoperative pain in adults – an overview of Cochrane reviews. Cochrane Database Syst Rev 2015; 9: CD008659.
5. Towheed T, Shea B, Wells G, Hochberg M. Analgesia and non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the hip. Cochrane Database Syst Rev 2000; 2: CD000517.
6. Watson MC, Brookes ST, Kirwan JR, Faulkner A. Non-aspirin, non-steroidal anti-inflammatory drugs for osteoarthritis of the knee. Cochrane Database Syst Rev 2000; 2: CD000142.
7. Apfelbaum JL, Ashburn MA, Connis RT, et al. Practice Guidelines for Acute Pain Management in the Perioperative Setting A Updated Report by the American Society of Anesthesiologists Task Force on Acute Pain Management. Anesthesiology 2012; 116: 248-73.
8. Hochberg MC, Altman RD, April KT, et al. American College of Rheumatology 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip, and knee. Arthritis Care Res 2012; 64: 465-74.
9. Wolfe MM, Lichtenstein DR, Singh G. Gastrointestinal toxicity of nonsteroidal antiinflammatory drugs. N Engl J Med 1999; 340: 1888-99.
10. Kearney PM, Baigent C, Godwin J, Emberson JR, Patrono C. Do selective cyclo-oxigenase-2 inhibitors and traditional non-steroidal anti-inflammatory drugs increase the risk of atherothrombosis? Meta-analysis of randomised trial. BMJ 2006; 332: 1302-08.
11. McGettigan P, Henry D. Cardiovascular risk and inhibition of cyclooxygenase. A systematic review of the observational studies of selective and nonselective inhibitors of cyclooxygenase 2. JAMA 2006; 296: 1633-44
12. C Bhala N, Emberson J, Merhi A, et al. Coxib and traditional NSAID Trialists’ (CNT) Collaboration. Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: Meta-analyses of individual participant data from randomized trials. Lancet 2013; 382: 769 -79.
13. Patak RV, Mookerjee BK, Bentzel CJ, Hysert PE, Bab M, Lee JB. Antagonism of the effects of furosemide by indomethacin in normal and hypertensive man. Prostaglandins 1975; 10: 649-59.
14. Tashima CK, Rose M. Pulmonary edema and salicylates. Ann Intern Med 1974; 81: 274-5.
15. Pope JE, Anderson JJ, Felson DT. A meta-analysis of the effects of nonsteroidal anti-inflammatory drugs on blood pressure. Arch Intern Med 1993; 153: 477-84.
16. Aw T, Haas S, Liew D, Krum H. Meta-analysis of cyclooxygenase-2 inhibitors and their effects on blood pressure. Arch Intern Med 2005; 165: 490–6.
17. Bombardier C, Laine L, Reicin A, et al. Comparison of upper gastrointestinal toxicity of rofecoxib and naproxen in patients with rheumatoid arthritis. Vigor Study Group. N Engl J Med 2000; 343: 1520-8.
18. Mukherjee DM, Nissen SE, Topol EJ. Risk of cardiovascular events associated with selective COX-2 inhibitors. JAMA 2001; 286: 954-9.
19. Liu G, Yan YP, Zheng XX, et al. Meta-analysis of nonsteroidal anti-inflammatory drug use and risk of atrial fibrillation. Am J Cardiol 2014; 114: 1523-9.
20. Patrono, C. Cardiovascular effects of cyclooxygenase-2 inhibitors: a mechanistic and clinical perspective. Br J Clin Pharmacol 2016; 82: 957-64.
21. Snowden S, Nelson R. The effects of nonsteroidal anti-inflammatory drugs on blood pressure in hypertensive patients. Cardiol Rev 2011; 19: 184-91.
22. Rossi GP, Seccia TM, Maniero C, Pessina AC. Drug-related hypertension and resistance to antihypertensive treatment: a call for action. J Hypertens 2011; 29: 2295- 309.
23. Dominick JA, Steven MW. Pharmacology and Cardiovascular Safety of Naproxen. Am J Cardiovasc Drugs 2017; 17: 97-107.
24. FitzGerald GA. Coxibs and Cardiovascular Disease. N Engl J Med 2004; 351: 1709-11.
25. Patrono C, Garcia Rodriguez LA, Landolfi R, Baigent C. Low dose aspirin for the prevention of atherothrombosis. N Engl J Med 2005; 353: 2373-83.
26. Bresalier RS, Sandler RS, Quan H, et al. Cardiovascular events associated with rofecoxib in a colorectal adenoma chemoprevention trial. N Engl J Med 2005; 352: 1092– 102.
27. Solomon SD, McMurray JJV, Pfeffer MA, et al. Cardiovascular risk associated with celecoxib in a clinical trial for colorectal adenoma prevention. N Engl J Med 2005; 352: 1071–80.
28. Press release European Medicines Agency concludes action on COX-2 inhibitors. En: http://www.ema.europa. eu/docs/en_GB/document_library/Press_release/2010/01/ WC500059088.pdf; consultado abril 2018.
29. EMA: PRAC recommends the same cardiovascular precautions for diclofenac as for selective COX-2 inhibitors. En: http://www.ema.europa.eu/docs/en_GB/document_library/ Press_release/2013/06/WC500144451.pdf; consultado abril 2018.
30. EMA: Updated advice on use of high-dose ibuprofen. En: http://www.ema.europa.eu/docs/en_GB/document_library/ Press_release /2015/05/ WC500187108.pdf; consultado abril 2018.
31. US Food and Drug Administration. Analysis and recommendations for agency action regarding non-steroidal anti-inflammatory drugs and cardiovascular risk. En: http://www.fda.gov/cder/drug/infopage/cox2/NSAIDdecisionMemo.pdf; consultado abril 2018.
32. Trelle S, Reichenbach S, Wandel S, et al. Cardiovascular safety of non-steroidal anti-inflammatory drugs: network meta-analysis. BMJ 2011; 342: c7086.
33. MacDonald TM, Hawkey CJ, Ford I, et al. Randomized trial of switching from prescribed non-selective non-steroidal anti-inflammatory drugs to prescribed celecoxib: the Standard care vs. Celecoxib Outcome Trial (SCOT). Eur Heart J 2017; 38: 1843-50.
34. Nissen SE, Yeomans ND, Solomon DH, et al. Cardiovascular Safety of Celecoxib, Naproxen, or Ibuprofen for Arthritis. N Engl J Med 2016; 375: 2519-29.
35. FitzGerald GA. ImPRECISION: Limitations to Interpretation of a Large Randomized Clinical Trial. Circulation 2017; 135: 113-5.
36. Urtasun MA, Prozzi GR, Marin GH, et al. Comment on: Coxibs Refocus Attention on the Cardiovascular Risks of Non-Aspirin NSAIDs. Letter to the Editor. Am J Cardiovasc Drugs 2017; 17: 493-5.
37. FDA Briefing Document. Joint Meeting of the Arthritis Advisory Committee and the Drug Safety and Risk Management Advisory Committee. En: https://www.fda.gov/ downloads/AdvisoryCommittees/CommitteesMeetingMaterials/Drugs/ArthritisAdvisoryCommittee/UCM605207. pdf; consultado abril 2018.
38. Patrono C, Baigent C. Coxibs, Traditional NSAIDs, and Cardiovascular Safety Post-PRECISION: What we thought we knew then and what we think we know now. Clin Pharmacol Ther 2017; 102: 238-45.
39. Lanza FL, Chan FKL, Quigley EM, et al. Guideline for Prevention of NSAID-Related Ulcer Complications. Am J Gastroenterol 2009; 104: 728-78.
40. EMA: Press release. Updated advice on use of high-dose ibuprofen. En: http://www.ema.europa.eu/ema/index.jsp?curl=pages/news_and_events/news/2015/05/ news_detail_002337.jsp&mid=WC0b01ac058004d5c1; consultado abril 2018.
41. MHRA: Drug Safety Update Volume 8 issue 11 June 2015 2. En: https://www.gov.uk/drug-safety-update; consultado abril 2018.
42. NICE. Non-steroidal anti-inflammatory drugs. Key therapeutic topic 2015. En: https://www.nice.org.uk/guidance/ ktt13; consultado abril 2018.
43. Catella-Lawson F, Reilly MP, Kapoor SC, et al. Cyclooxygenase inhibitors and the antiplatelet effects of aspirin. N Engl J Med 2001; 345: 1809-17.
44. Capone L, Sciulli MG, Tacconelli S, et al. Pharmacodynamic interaction of naproxen with low-dose aspirin in healthy subjects. J Am Coll Cardiol 2005; 45: 1295-301.
45. Anzellotti P, Capone ML, Jeyam A, et al. Low-dose naproxen interferes with the antiplatelet effects of aspirin in healthy subjects: recommendations to minimize the functional consequences. Arthritis Rheum. 2011; 63: 850-9.
46. FDA: Information about taking ibuprofen and aspirin together. En: https://www.fda.gov/Drugs/DrugSafety/ ucm110510.htm; consultado abril 2018.
