EDUARDO N. FAURE, MARÍA JIMENA SOUTELO, MARÍA CLARA FRITZ, AYELÉN MARTÍN, YAMILE MUSRI, RUBÉN LUTFI
Servicio de Endocrinología, Complejo Médico Churruca-Visca. Buenos Aires, Argentina
Resumen El objetivo del estudio fue evaluar la asociación del índice de masa corporal (IMC) con las características clínico-patológicas y la recurrencia del carcinoma papilar de tiroides. La cohorte consistió en 208 pacientes con carcinoma papilar de tiroides diagnosticado en 2003-2014, en Buenos Aires, Argentina. El seguimiento fue semestral los primeros 2 años y luego anual. Los pacientes fueron agrupados según el IMC de la siguiente manera: IMC < 18.5 kg/m2 (bajo peso); IMC ≥ 18.5 y < 25 kg/m2 (peso normal); IMC ≥ 25 y < 30 kg/m2 (sobrepeso); IMC ≥ 30 kg/m2 (obesidad). Dos patólogos experimentados revisaron todas las muestras para determinar las características del tumor y la extensión de la enfermedad. La recurrencia tumoral fue evaluada mediante diagnóstico por imágenes y confirmación histológica. Se utilizó un análisis de regresión para identificar la asociación del IMC con las características clínico-patológicas del tumor y con la recurrencia. El aumento de 5 puntos en el IMC se asoció significativamente con mayor tamaño tumoral (OR 1.21; IC 95% 1.1-1.5; p = 0.01) y con mayor extensión extranodal de las metástasis cervicales (OR 1.11; IC95% 1.06-1.21; p = 0.03). No se observó asociación entre el aumento del IMC y el riesgo de recurrencia (HR 1.11; IC95% 0.91-1.22). En conclusión, se demostró una asociación directa del IMC con el tamaño tumoral y la extensión extranodal pero no con la recurrencia del tumor.
Palabras clave: índice de masa corporal, carcinoma papilar de tiroides, tiroides, pronóstico, Argentina
Abstract
Association between body mass index and aggressiveness of papillary thyroid carcinoma.
The aim of the study was to evaluate the association of the body mass index (BMI) with the clinical-pathological characteristics and the recurrence of papillary thyroid carcinoma. The cohort consisted of 208 patients with papillary thyroid carcinoma diagnosed in 2003-2014, in Buenos Aires, Argentina. The patients were grouped according to the BMI as follows: BMI <18.5 kg/m2 (low weight); BMI ≥ 18.5 and < 25 kg/m2 (normal weight); BMI ≥ 25 and < 30 kg/m2 (overweight); BMI ≥ 30 kg / m2 (obesity). Two experienced pathologists reviewed and cross-checked all pathology specimens to confirm diagnosis, tumor characteristics and extent of the disease. All patients were followed every 6 months for 2 years, and annually thereafter. Recurrences were searched by using diagnostic imaging and histological confirmation when necessary. Regression analysis was applied to define associations of BMI with clinical, pathological, and prognosis features of the disease. A 5-point increase in BMI was significantly associated with tumor size (OR 1.21; 95% CI 1.1-1.5; p = 0.01) and greater extranodal extension in cervical metastases (OR 1.11; 95% CI 1.06-1.21; p = 0.03). The analysis of prognostic variables showed no association between increase in BMI and risk of recurrence (HR 1.11; 95% CI 0.91-1.22). In conclusion, we found that BMI relates directly with tumor size and extranodal extension, but not with recurrence.
Key words: body mass index, papillary thyroid carcinoma, thyroid, prognosis, Argentina
Recibido: 7-III-2017 Aceptado: 12-V-2018
Dirección postal: Dr. Eduardo Faure, Av. Santa Fe 2606 3er piso, 1425 Buenos Aires, Argentina
e-mail: eduardofaure@gmail.com
La prevalencia mundial de nódulos tiroideos palpables en áreas iodo suficientes es aproximadamente 5% en mujeres y 1% en hombres. Sin embargo, la ecografía de alta resolución los detecta en 19-68% de individuos seleccionados al azar, con mayor frecuencia en mujeres y ancianos1. Entre el 7 y el 15% de los pacientes con nódulos presentan cáncer de tiroides, con variaciones según edad, sexo, exposición a radiación y antecedentes familiares, entre otros factores. La vasta mayoría (hasta 90%) de los cánceres de tiroides (CT) son de tipo diferenciado (CDT), en sus variantes papilar (CPT) y folicular1.
En los últimos 10 años, la incidencia del cáncer de tiroides ha aumentado 4.5% por año, una tasa muy superior a la de otros tipos de cáncer, sin un aumento concomitante de la mortalidad2. Asimismo, el tamaño tumoral al diagnóstico ha disminuido, hecho atribuible al creciente uso del diagnóstico por imágenes1. Ciertamente, el rol de la ecografía es fundamental en el diagnóstico del CDT. La detección de imágenes ecográficas altamente sugestivas de cáncer de tiroides permite un diagnóstico precoz, un tratamiento efectivo y un mejor pronóstico a largo plazo3. Sin embargo, el screening puede resultar en sobrediagnóstico, con la detección de tumores pequeños o indolentes que podrían no afectar la morbimortalidad. Por ende, se discute el beneficio de tratamiento precoz del CDT diagnosticado mediante screening en adultos asintomáticos.
Por otra parte, el creciente acceso al diagnóstico precoz podría no explicar completamente el incremento en la incidencia, por lo que otros factores etiológicos han sido propuestos, como exposición a disruptores (radiaciones), tóxicos (nitratos), y mayor prevalencia de obesidad1. Se han formulado varias hipótesis sobre la causa de la asociación entre obesidad y CDT, las que consideran la participación de factores tales como inflamación, estrés oxidativo, hiperinsulinemia y adipoquinas4.
La obesidad es un serio problema de salud mundial. En nuestro país, la última Encuesta Nacional de Factores de Riesgo para Enfermedades no Transmisibles reveló prevalencias tan altas como 37.1% de sobrepeso y 20.8% de obesidad5. Múltiples estudios han demostrado que la obesidad se asocia a diversas enfermedades crónicas y es conocida su contribución al desarrollo de cáncer de colon, mama, riñón y endometrio6-8. También es un factor adverso en el pronóstico de varios tipos de carcinomas. El índice de masa corporal (IMC) está asociado significativamente con mayor tasa de mortalidad por cáncer de esófago, colon, hígado, vesícula, páncreas, endometrio, ovario, mama y riñón.
Aunque ha sido abundantemente documentada4, 9, 10, la asociación entre IMC y riesgo de CT continúa siendo objeto de controversia y los mecanismos subyacentes no han sido esclarecidos8-14. La hipótesis más señalada es la resistencia a la insulina, la que incluso ha sido avalada por estudios realizados en nuestro país15, 16.
El objetivo del estudio fue evaluar la asociación del IMC con las características clínico-patológicas y la recurrencia de la enfermedad en casos de CPT en una cohorte de pacientes de Buenos Aires, Argentina.
Materiales y métodos
Fueron incluidos retrospectivamente los pacientes con diagnóstico de CPT realizado entre 2003 y 2014 en el Complejo Médico Churruca-Visca de Buenos Aires. Los criterios de inclusión fueron: 1) diagnóstico de carcinoma papilar de tiroides, con tiroidectomía total y posterior radio-ablación; 2) seguimiento mínimo: un año post-tratamiento inicial; 3) información del seguimiento disponible. El criterio utilizado para el vaciamiento cervical fue: diagnóstico citológico de metástasis previo a la cirugía o tumores de gran tamaño (T3 y T4 según la clasificación de TNM AJJCC)17.
Fueron revisadas las historias clínicas, los informes quirúrgicos y anatomopatológicos para definir las características clínico-patológicas, tanto al momento del diagnóstico como durante el seguimiento. Se registró la recurrencia tumoral y el estatus de enfermedad al final del seguimiento.
En cada paciente se calculó el IMC a través de la altura y el peso, medidos en la etapa pre-quirúrgica. Se aplicó la clasificación en cuatro grupos de IMC establecida por la Organización Mundial de la Salud18, a saber: IMC < 18.5 kg/m2 (bajo peso); IMC ≥18.5 y < 25 kg/m2 (peso normal); IMC ≥ 25 y <30 kg/m2 (sobrepeso); IMC ≥ 30 kg/m2 (obesidad). Los niveles séricos de TSH fueron determinados durante la evaluación pre-quirúrgica utilizando el método inmuno-radiométrico (TSH IRMA; Immunotech, República Checa). Dos patólogos experimentados revisaron todas las muestras en forma independiente para confirmar el diagnóstico de CPT, las características del tumor y la extensión del mismo. Se utilizó la estadificación tumor-node-metastasis (TNM) basada en la 7ma edición UICC/AJCC17, así como la clasificación de extensión tumoral propuesta por la American Thyroid Association1. Según esta última, los pacientes fueron clasificados en tres grupos: con riesgo bajo, intermedio y alto. Las variables anatomopatológicas analizadas fueron: tamaño tumoral, subtipo histológico, multicentricidad, bilateralidad, extensión extratiroidea, invasión vascular, metástasis ganglionar local y metástasis a distancia.
El seguimiento consistió en evaluaciones clínicas, mediciones séricas de tiroglobulina (Tg), anticuerpos anti-Tg y ecografía cervical cada 6 meses durante 2 años, y luego cada año. La determinación de Tg y anticuerpos anti-Tg se realizó mediante quimioluminiscencia (Access Ultrasensitive Beckman Coulter). Ante la identificación de una elevación en los niveles de Tg o anticuerpos anti-Tg, se evaluó la presencia de recurrencia tumoral utilizando métodos de imágenes complementarios y confirmación histológica. La recurrencia tumoral fue definida como la evidencia de enfermedad anatomopatológica en los casos que habían cumplido con los criterios de remisión tumoral8. El criterio de remisión se estableció por la ausencia de evidencia clínica e imagenológica del tumor, con niveles de tiroglobulina ≤ 1 ng/ml durante la terapia supresora con levotiroxina y la estimulación, ya fuera mediante la suspensión de la hormona tiroidea o con tirotrofina recombinante humana (rhTSH) y ausencia de anticuerpos anti-Tg. Se definió persistencia estructural a la enfermedad demostrable clínicamente o por estudios de imágenes (ecografía, rastreo corporal total o tomografía computarizada) y persistencia bioquímica al hallazgo de niveles de Tg > 1 ng/ml bajo tratamiento hormonal o luego de la estimulación con ausencia de correlato estructural.
Se obtuvo la aprobación del Comité de Ética de la Institución y los pacientes incluidos en el estudio brindaron su consentimiento informado.
Se evaluó la asociación entre el IMC y las características clínico-patológicas del CPT mediante un modelo de regresión logística, estimando el odds ratio (OR) con su IC de 95%. El IMC fue considerado la variable independiente y las características clínico-patológicas fueron variables dependientes. Un modelo de regresión de Cox o de riesgo proporcional fue utilizado para analizar el riesgo de recurrencia durante el seguimiento con su IC de 95%. El análisis del tiempo libre de recurrencia fue realizado mediante el método de Kaplan-Meier y la supervivencia libre de recurrencia fue comparada entre los grupos de IMC. Los análisis estadísticos fueron llevados a cabo mediante el programa Stata 10.1 y se consideró diferencia significativa un valor de p < 0.05.
Resultados
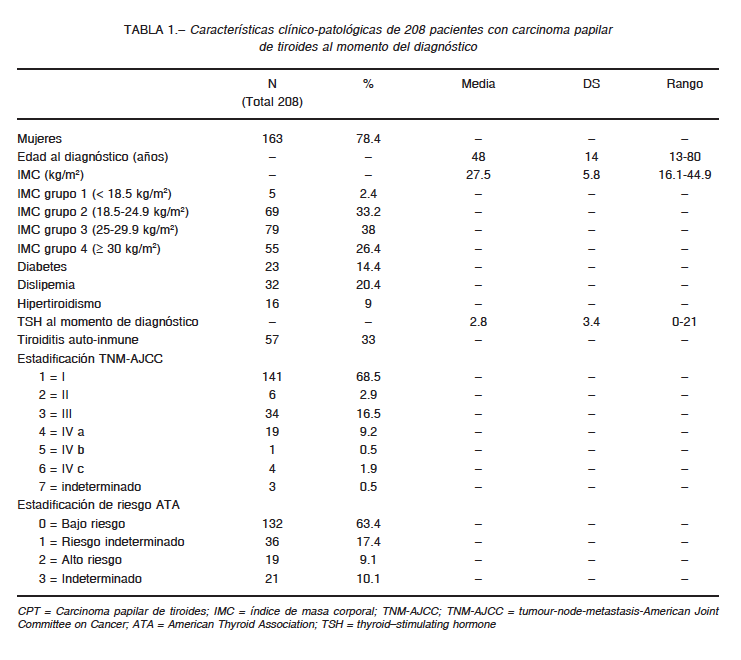
Se incluyeron 208 pacientes. La edad media al momento de su inclusión fue 48 ± 14 años. El 78% eran mujeres. El IMC medio fue 27.5 ± 5.8 kg/m2. El subtipo histológico de CPT más frecuente fue la variante clásica (59%), seguida por la variante folicular. El tiempo medio de seguimiento fue 59 meses (rango 12-192). El 14.4% de los pacientes tenía diabetes y el 20.4% dislipemia. El 33% presentó anticuerpos anti-Tg, porcentaje mayor al observado en la población general pero similar al detectado en pacientes con carcinoma de tiroides. Los valores de TSH no mostraron relación con las características histopatológicas. El resto de las características clínicas se describen en detalle en la Tabla 1.
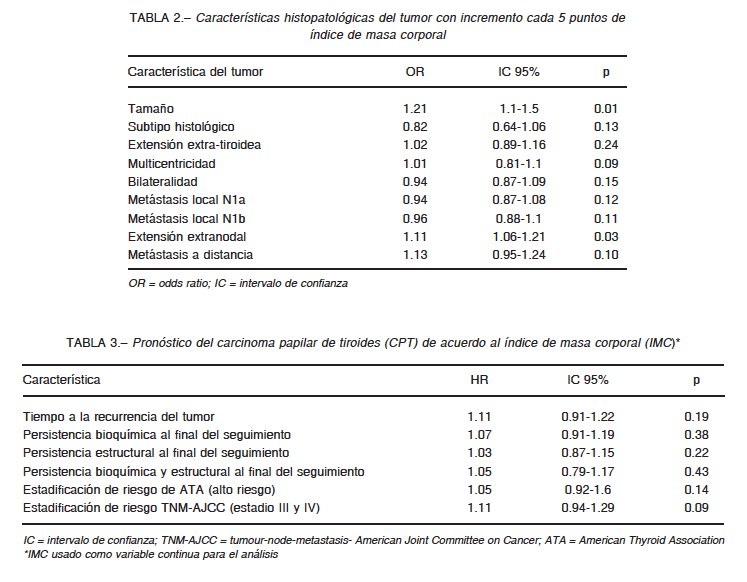
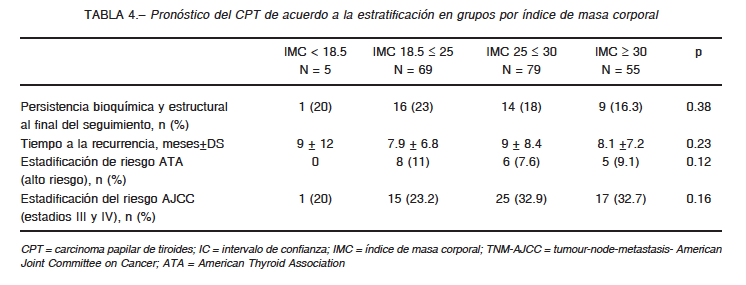
Con respecto a la asociación entre las características clínico-patológicas del CPT, se observó que un incremento del IMC en 5 puntos se asociaba significativamente con un mayor tamaño tumoral y una mayor extensión extranodal de las metástasis cervicales, mientras que las otras variables clínico-patológicas analizadas no mostraron asociación significativa (Tabla 2). Durante el seguimiento, no observamos asociación del IMC con el riesgo de recurrencia ni con la persistencia del tumor, tanto bioquímica como estructural. Observamos peor pronóstico en pacientes con mayor IMC, pero la asociación no alcanzó valores significativos (Tablas 3 y 4).
Discusión
En nuestro estudio, observamos que el incremento del IMC ajustado por otras variables se asoció significativamente con mayor tamaño tumoral y mayor extensión extranodal en las metástasis cervicales. No encontramos asociación entre el IMC y el riesgo de recurrencia o persistencia tumoral.
Estudios previos demostraron que la obesidad es un factor de riesgo para diferentes tipos de tumores, incluyendo el CPT8, 10-12. Hwang y col. demostraron que un incremento ≥ 10 kg de peso corporal después de los 35 años se asoció con un aumento del riesgo de CPT comparado con los individuos que mantuvieron su peso estable19. Kithara y col. analizaron cinco estudios prospectivos en EE.UU. y también evidenciaron que un incremento del IMC se asociaba con un mayor riesgo de cáncer de tiroides en ambos sexos9. Recientemente, Kim y col. describieron una asociación entre IMC y agresividad
clínico-patológica del CPT8. En dicho estudio observaron que, a mayor IMC mayor era el tamaño del tumor y la extensión extranodal así como la invasión regional. En una reciente publicación, Dieringer y col. hallaron una asociación significativa entre el incremento del IMC y el mayor tamaño del tumor. Sin embargo, no observaron asociación con estadios más avanzados20. Por otra parte, Paes y col. no encontraron asociación significativa entre el incremento del IMC y el riesgo de desarrollo de CPT, ni el riesgo de recurrencia21.
Nuestros resultados coinciden con los de publicaciones previas en las cuales se halló que, a mayor IMC, mayor es la agresividad del tumor. Una explicación de esto podría estar vinculada con los cambios hormonales (TSH e insulina) que se desencadenan en pacientes obesos, los que influyen sobre la diferenciación de las células de la tiroides22. En estudios recientes se destaca la importancia de las vías de señalización de la proteína quinasa B (PKB/AKT) y diana de rapamicina en células de mamífero (mammalian Target of Rapamycin = mTOR), mediadas por insulina23, 24. Estas vías han sido propuestas como posibles objetivos terapéuticos en el cáncer asociado a la obesidad8, 24-26. Uddin y col. demostraron in vitro que la leptina estimula la proliferación celular e inhibe la apoptosis a través de la activación de la vía de señalización fosfatidilinositol-3-quinasa (PI3K)/AKT27. La inhibición de la actividad de PI3K a través de LY294002 reduce la actividad de la vía señalización PI3K/AKT mediada por leptina. El silenciamiento génico del receptor de leptina en las células de CPT resultó en una menor expresión de la vía PI3K/AKT, de proteínas anti-apoptóticas como la del linfoma de células B extra grande (B-cell lymphoma-extra large = Bcl-xL) y expresión de la proteína inhibidora de la apoptosis asociada a X (X-linked inhibitor of apoptosis protein = XIAP), lo que sugiere que la patogenia del CPT asociada a la leptina ocurre en dichas etapas finales de la vía de señalización27. Esto muestra que la vía de la leptina tiene un rol importante en el desarrollo del CPT a través de la vía PI3K/AKT y el receptor de leptina, lo que la señala como un potencial marcador pronóstico asociado a un fenotipo agresivo y a un menor período libre de enfermedad27, 28. Estos hallazgos moleculares sugieren que el aumento de IMC se vincula a mayor agresividad y peor pronóstico del cáncer de tiroides.
La principal limitación de nuestro estudio es su carácter retrospectivo y el moderado número de pacientes incluidos en cada grupo de IMC. Sin embargo, el exhaustivo seguimiento clínico realizado permitió alcanzar el objetivo propuesto.
En conclusión, en nuestro estudio el incremento del IMC se asoció con mayor tamaño tumoral y mayor extensión local y regional del CPT. Si bien observamos peor pronóstico en aquellos con mayor IMC, este hallazgo no fue estadísticamente significativo. Un seguimiento más prolongado en un mayor número de pacientes permitirá obtener mayor evidencia para esclarecer las asociaciones observadas.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Haugen BR, Alexander EK, Bible KC, et al. 2015 American Thyroid Association management guidelines for adult patients with thyroid nodules and differentiated thyroid cancer: The American Thyroid Association guidelines task force on thyroid nodules and differentiated thyroid cancer. Thyroid 2016; 26: 1-133.
2. US Preventive Services Task Force, Bibbins-Domingo K, Grossman DC, et al. Screening for thyroid cancer: US preventive services task force recommendation statement. JAMA 2017; 317: 1882-7.
3. Lin JS, Bowles EJA, Williams SB, Morrison CC. Screening for thyroid cancer: Updated evidence report and systematic review for the US preventive services task force. JAMA 2017; 317: 1888-903.
4. Pappa T, Alevizaki M. Obesity and thyroid cancer: A clinical update. Thyroid 2014; 24: 190-9.
5. Tercera Encuesta Nacional de Factores de Riesgo para Enfermedades no Transmisibles. Argentina 2013. Indec, Ministerio de Salud. En: http://www.msal.gob.ar/images/stories/bes/graficos/0000000544cnt-2015_09_04_encuesta_nacional_factores_riesgo.pdf, consultado en octubre 2016.
6. Kilfoy BA, Zheng T, Holford TR, et al. International patterns and trends in thyroid cancer incidence, 1973-2002. Cancer Causes Control 2009; 20: 525-31.
7. Enewold L, Zhu K, Ron E, et al. Rising thyroid cancer incidence in the United States by demographic and tumor characteristics, 1980-2005. Cancer Epidemiol Biomarkers Prev 2009; 18: 784-91.
8. Kim HJ, Kim NK, Choi JH, et al. Associations between body mass index and clinico-pathological characteristics of papillary thyroid cancer. Clin Endocrinol (Oxf) 2013; 78: 134-40.
9. Kitahara CM, Platz EA, Freeman LE, et al. Obesity and thyroid cancer risk among U.S. Men and women: A pooled analysis of five prospective studies. Cancer Epidemiol Biomarkers Prev 2011; 20: 464-72.
10. Vuong HG, Altibi AM, Abdelhamid AH, et al. The changing characteristics and molecular profiles of papillary thyroid carcinoma over time: A systematic review. Oncotarget 2017; 8: 10637-49.
11. Abelson P, Kennedy D. The obesity epidemic. Science 2004; 304: 1413.
12. Brindel P, Doyon F, Rachedi F, et al. Anthropometric factors in differentiated thyroid cancer in french polynesia: A case-control study. Cancer Causes Control 2009; 20: 581-90.
13. Renehan AG, Tyson M, Egger M, Heller RF, Zwahlen M. Body-mass index and incidence of cancer: A systematic review and meta-analysis of prospective observational studies. Lancet 2008; 371: 569-78.
14. Tresallet C, Seman M, Tissier F, et al. The incidence of papillary thyroid carcinoma and outcomes in operative patients according to their body mass indices. Surgery 2014; 156: 1145-52.
15. Rezzonico JN, Rezzonico M, Pusiol E, Pitoia F, Niepomniszcze H. Increased prevalence of insulin resistance in patients with differentiated thyroid carcinoma. Metab Syndr Relat Disord 2009; 7: 375-80.
16. Pitoia F, Abelleira E, Bueno F, Urciuoli C, Schmidt A, Niepomniszcze H. Insulin resistance is another factor that increases the risk of recurrence in patients with thyroid cancer. Endocrine 2015; 48: 894-901.
17. AJCC (American Joint Committee on Cancer). (2010) thyroid. In: S.B. Edge, d.R. Byrd, c.C. Compton et al., eds. Cancer staging manual, 7th ed. New York: Sringer-Verlag, 2010, p 87-96.
18. World Health Organization consultation on obesity. Obesity: Preventing and managing the global epidemic. Report of a WHO consultation on obesity, 3-5 june 1997. Geneva: World Health Organization, 1997.
19. Hwang Y, Lee KE, Park YJ, et al. Annual average changes in adult obesity as a risk factor for papillary thyroid cancer: A large-scale case-control study. Medicine 2016; 95: e2893.
20. Dieringer P, Klass EM, Caine B, Smith-Gagen J. Associations between body mass and papillary thyroid cancer stage and tumor size: A population-based study. J Cancer Res Clin Oncol 2015; 141: 93-8.
21. Paes JE, Hua K, Nagy R, Kloos RT, Jarjoura D, Ringel MD. The relationship between body mass index and thyroid cancer pathology features and outcomes: A clinicopathological cohort study. J Clin Endocrinol Metab 2010; 95: 4244-50.
22. de Luca C, Olefsky JM. Inflammation and insulin resistance. FEBS Lett 2008; 582: 97-105.
23. Hursting SD, Lashinger LM, Wheatley KW, et al. Reducing the weight of cancer: Mechanistic targets for breaking the obesity-carcinogenesis link. Best Pract Res Clin Endocrinol Metab 2008; 22: 659-69.
24. Stattin P, Bjor O, Ferrari P, et al. Prospective study of hyperglycemia and cancer risk. Diabetes Care 2007; 30: 561-7.
25. Barb D, Williams CJ, Neuwirth AK, Mantzoros CS. Adiponectin in relation to malignancies: A review of existing basic research and clinical evidence. Am J Clin Nutr 2007; 86: s858-66.
26. Paz-Filho G, Lim EL, Wong ML, Licinio J. Associations between adipokines and obesity-related cancer. Front Biosci (Landmark Ed) 2011; 16: 1634-50.
27. Uddin S, Bavi P, Siraj AK, et al. Leptin-r and its association with pi3k/akt signaling pathway in papillary thyroid carcinoma. Endocr Relat Cancer 2010; 17: 191-202.
28. Wei EK, Giovannucci E, Fuchs CS, Willett WC, Mantzoros CS. Low plasma adiponectin levels and risk of colorectal cancer in men: A prospective study. J Natl Cancer Inst 2005; 97: 1688-94.
