MANUEL A. BUHL1, GRACIELA GÓMEZ1, MARÍA VICTORIA COLLADO1, ELISABET M. ODDO2,
MARINA KHOURY3, PABLO J. AZURMENDI2, JUDITH SARANO1
1Servicio de Inmunología, 2Laboratorio de Nefrología Experimental y Bioquímica Molecular, 3Estadística y
Metodología de la Investigación, Instituto de Investigaciones Médicas (IDIM) Alfredo Lanari,
Facultad de Medicina, Universidad de Buenos Aires, Argentina
Resumen La azatioprina es una tiopurina que presenta rango terapéutico estrecho y marcada toxicidad hematológica y hepática. La tiopurina S-metiltransferasa es una enzima que metaboliza ese grupo de drogas. Mutaciones en el gen que codifica dicha enzima aumentan el riesgo de presentar eventos adversos, por lo que su estudio farmacogenético permite contar con información para el diseño de la estrategia terapéutica. Sin embargo, su utilidad en el medio local no está completamente establecida. Fueron incluidos 45 sujetos (13 hombres) con indicación de azatioprina. Se determinó la presencia de las mutaciones *2, *3A, *3B y *3C de TMPT por PCR-RFLP y se analizó la relación entre el genotipo y la incidencia de eventos adversos relacionados al fármaco. Nueve portaban al menos un alelo no funcional, uno de ellos con genotipo *3A/*3A. Se detectó toxicidad en 3 de los 18 que iniciaron tratamiento con azatioprina: 2 pacientes con genotipo normal presentaron eventos adversos leves, y el único evento adverso de gravedad (aplasia medular) ocurrió en el sujeto con genotipo homocigota mutado. El único que presentó genotipo homocigota mutado desarrolló el más grave de los eventos adversos registrados, a pesar de estar en tratamiento con dosis bajas de azatioprina. Por este motivo, la determinación del genotipo de la tiopurina metiltransferasa pareciera ser de utilidad, pero no reemplaza la necesidad de seguimiento clínico y bioquímico en pacientes en tratamiento con tiopurinas.
Palabras clave: mutación tiopurina metiltransferasa, eventos adversos por mutación TPMT, variantes farmacogenéticas, azatioprina, metabolismo alterado de tiopurinas
Abstract Genetic polymorphisms of thiopurine methyltransferase and incidence of adverse events in patients with medical indication of azathioprine. Azathioprine is a thiopurine which has a narrow therapeutic index and marked hematological and hepatic toxicity. Thiopurine s-methyltransferase is an enzyme involved in the metabolism of thiopurines. Mutations in the gene that encodes the enzyme may augment the risk of adverse events. For that reason, pharmacogenetic determinations prior to the initiation of therapy can provide useful information for the future therapeutic strategy. Nevertheless, its utility in the local environment is not completely established. Forty-five subjects (13 men) who had been prescribed azathioprine were included. The presence of *2, *3A, *3B and *3C mutations were determined by PCR-RFLP, and the relationship between genotype and incidence of adverse events related to the drug was analyzed. Nine carried at least one non-functional allele, one of them with *3A/*3A genotype. Among the eighteen patients who initiated treatment with azathioprine, toxicity was detected in 3 cases: 2 mild events were observed in patients with normal genotype, and the only serious event (bone marrow suppression) occurred in the individual with homozygous mutant genotype. The only homozygous mutant patient developed the most severe of the registered events, in spite of being under treatment with low doses of azathioprine. This is the reason why enzymatic determination could be of utility, even though it does not replace clinical and biochemical follow-up in patients under thiopurine treatment.
Key words: thiopurine methyltransferase deficiency, TPMT deficiency, pharmacogenomic variant, azathioprine, poor metabolism of thiopurines
Recibido: 22-IX-2017 Aceptado: 19-I-2018
Dirección postal: Manuel A. Buhl, Servicio de Inmunología, Instituto de Investigaciones Médicas Alfredo Lanari, Combatientes de Malvinas 3150, 1427 Buenos Aires, Argentina
e-mail: manuelbuhl@hotmail.com
La enzima tiopurina S-metiltransferasa genera compuestos con menor actividad metabólica de un conjunto de drogas denominadas tiopurinas, como tioguanina, mercaptopurina y su prodroga, la azatioprina (AZA). Las tiopurinas son utilizadas en el tratamiento de enfermedades reumatológicas, dermatológicas, inmunológicas, hematológicas y neoplásicas1-4. TPMT, el gen que la codi- fica, puede presentar mutaciones asociadas a déficit de la actividad enzimática, acumulación de nucleótidos activos circulantes y mayor riesgo de toxicidad medular grave u otros eventos adversos (EA) potencialmente letales, aún con dosis convencionales de tiopurinas1-5.
Distintos autores recomiendan determinar la actividad de la enzima mediante la fenotipi cación (medición de la actividad enzimática) o genotipi cación (estudio de las variantes alélicas de TPMT) en los individuos que recibirán tiopurinas, lo que permitiría ajustar la dosis inicial o elegir un fármaco alternativo1, 2, 6.
Según nuestro conocimiento, es escasa la información local sobre la frecuencia de dichas mutaciones y de EA relacionados en sujetos tratados con tiopurinas. El objetivo del presente trabajo es describir las variantes genéticas de TPMT en los pacientes con indicación de tratamiento con AZA y explorar la relación entre el genotipo de TPMT y la incidencia de EA relacionados con el fármaco.
Materiales y métodos
Se obtuvieron muestras de sangre entera entre el mes de agosto de 2012 y mayo del 2016 para la determinación geno- típica de TPMT en mayores de 18 años con indicación de tra- tamiento con AZA, los que dieron su consentimiento informado por escrito. Se revisaron las historias clínicas de los mismos entre junio y septiembre de 2016 para estudiar a aquellos que habían recibido el tratamiento. Se excluyeron menores de 18 años y aquellos con neutropenia crítica (< 500 neutró los/mm3) previo al inicio de tratamiento con AZA. En todos los sujetos se registró sexo, edad, etnia según criterio del grupo Gladel7, genotipo de TPMT y si recibió tratamiento con AZA.
El genotipo de TPMT se estudió por reacción en cadena de polimerasa seguido de análisis de fragmentos post-restricción enzimática secuencia especí ca de los ampli cados (PCR- RFLP). Las reacciones que determinan los alelos *3A, *3B y *3C se realizaron según Ishioka y col.8. Para detectar el alelo *2, se diseñaron cebadores mediante el software Pri- mer3 (http://primer3.ut.ee/), que introducen un sitio de corte para la enzima de restricción PstI para la secuencia wild type. La especi cidad de todos los cebadores fue analizada con los programas in silico-PCR de UCSC Genome Brow- ser (https://genome.ucsc.edu/cgi-bin/hgPcr?hgsid=6031598 77_7aobLxcODxIYjfnawgSQO6GLVz88) y Primer-Blast de NCBI (https://www.ncbi.nlm.nih.gov/tools/primer-blast/index. cgi?LINK_LOC=BlastHome). La visualización de los patro- nes de bandas se realizó en geles de agarosa teñidos con bromuro de etidio y los diferentes genotipos se interpretaron según los resultados de las tres reacciones combinadas. Se clasi caron como homocigota mutado (ambos alelos distintos de *1), heterocigota (*1/*2, *1/*3A, *1/*3B y *1/*3C) y homo- cigota normal (*1/*1).
En todos los pacientes se relevó: fecha de inicio de trata- miento, peso más próximo, dosis máxima utilizada, tratamiento concomitante con fármacos que presentaban: 1) EA análogos (corticoides, metotrexato, hidroxicloroquina y ciclosfosfami- da) o 2) interacciones (mesalazina, sulfasalazina, in iximab, alopurinol y naproxeno) con la AZA. También se estudiaron los diagnósticos que motivaron la indicación de la tiopurina y los resultados de hemograma y función hepática previos al inicio del tratamiento.
Los diagnósticos que motivaron la indicación fueron cla- si cados en: trasplante, enfermedad reumatológica (lupus eritematoso sistémico, vasculitis, miositis o síndrome de superposición), enfermedad del tracto gastrointestinal y glán- dulas anexas (hepatitis autoinmune, cirrosis biliar primaria o colitis ulcerosa) y enfermedad neurológica (miastenia gravis o encefalitis autoinmune).
Se consideró alteración funcional hepática a la elevación de los niveles de transaminasas dos veces por encima del límite superior de la normalidad, al menos en una ocasión. Se consideró hepatotoxicidad asociada al tratamiento si ocurrió tras haber iniciado tratamiento con AZA y los valores dismi- nuyeron al reducir la dosis o interrumpir el mismo9, 10.
Se consideró alteración hematológica a la presencia de leucopenia (glóbulos blancos < 3000/mm3)11, 12 y/o plaqueto- penia (< 100 000/mm3)11 y/o anemia (hemoglobina < 12 g/dl en mujeres o < 14 g/dl en hombres)13, al menos en una ocasión. Se consideró mielotoxicidad asociada al tratamiento si ocurrió tras haber iniciado AZA.
En los pacientes que presentaron toxicidad hematológica o hepática, se registró la dosis de AZA recibida, hemograma y valor de transaminasas al momento del EA, así como el tiempo de tratamiento. En los individuos que no presentaron EA, se registró el resultado del último hemograma y valor de transaminasas disponible.
Las determinaciones de transaminasas hepáticas, aspar- tato amino transferasa (ASAT) y alanina amino transferasa (ALAT) en suero se realizaron en autoanalizador Architect i2000 (Abbott Diagnostics, Estados Unidos de América) por método UV cinético para ASAT (NADH (sin P-5’-P)) [VN < 41 U/l] y ALAT (NAD (sin P-5 ́-P)) [VN < 42 U/l]. El recuento de plaquetas, glóbulos blancos y rojos y dosaje de hemoglobina se efectuó en plasma obtenido con EDTA en contador hema- tológico (Sysmex, Japón).
Los resultados se presentan como mediana y rango en variables numéricas y como frecuencia o porcentaje en variables categóricas. Los intervalos de confianza (IC) se calcularon para el 95%. Se planificó un tamaño de muestra de 33 personas o más para una frecuencia esperada de al menos un alelo no funcional en genotipo TPMT de 14.3%4, un nivel de confianza del 95% y una semi-amplitud del in- tervalo de 12%.
El proyecto y el modelo de consentimiento informado fueron aprobados por el Comité de Ética del Instituto de Investigaciones Médicas Alfredo Lanari, UBA.
Resultados
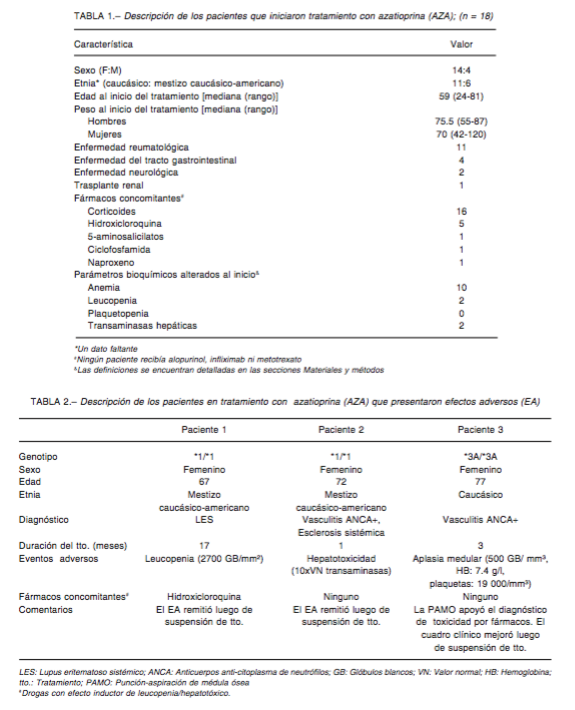
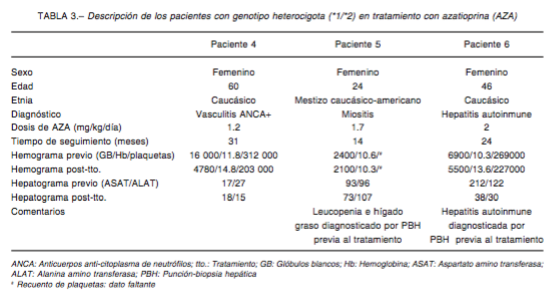
Se identi caron 45 individuos (13 hombres) con indicación de AZA, a quienes se les realizó genotipi cación. Las frecuencias de genotipo de TPMT fueron: 36 homocigo- tas normales, 8 heterocigotas (*1/*2 n = 6, *1/*3A n = 1, *1/*3B n = 1) y 1 homocigota mutado (*3A/*3A), para un total de 9 sujetos con al menos un alelo no funcional (20%; IC 95% = 16.96-23.04). Dieciocho iniciaron tratamiento con AZA (Tabla 1), seguidos durante 24 [8-268] meses, mientras que 27 no fueron incluidos en este análisis por recibir tratamiento con drogas alternativas a la AZA o pérdida de seguimiento. En 3 casos se detectó toxicidad (Tabla 2); todos recibían la dosis mínima recomendada (1 mg/kg/día) de AZA al momento del EA. El único EA de gravedad ocurrió en una paciente con genotipo ho- mocigota mutado; los otros dos EA fueron de resolución ambulatoria. A su vez, fue posible evaluar el seguimiento en 3 de los 8 heterocigotas, que presentaron genotipo *1/*2 (Tabla 3) y que, tratados con dosis de 1.2-2 mg/kg/ día no mostraron alteraciones hepáticas o hematológicas atribuibles al fármaco.
Discusión
La enzima tiopurina S-metiltransferasa es parte de una cascada enzimática responsable del metabolismo de las
drogas del grupo de las tiopurinas, entre ellas la AZA14. La AZA es frecuentemente utilizada en diferentes espe- cialidades como ahorradora de corticoides para tratar enfermedades in amatorias crónicas y autoinmunes.
La interacción de la AZA con la enzima genera metabolitos secundarios; se postula que dichos metabolitos activos, por ser nucleótidos de tioguanina, son incorporados en el ADN leucocitario con la consiguiente muerte celular, mecanismo compatible con la supresión medular que provocan2-3.
La actividad de la enzima puede ser determinada en forma directa por fenotipi cación, o por genotipi cación. La fenotipi cación mediante el dosaje de la actividad plasmática resulta con able, pero re eja su actividad en un momento de nido y numerosos factores analíticos pueden afectar la reacción (ej., transfusiones y factores físico-químicos). Tampoco resulta muy efectiva en iden- ti car sujetos con baja actividad de la enzima14-16.
La genotipi cación tiene menor variabilidad metodoló- gica, no se modi ca por actividad de la enfermedad ni el uso de otros fármacos, es menos afectada por factores pre-analíticos y posee alta especi cidad (cercana al 100%) para identi car tanto el genotipo normal en indi- viduos con actividad normal o alta, como el heterocigota en individuos con actividad intermedia de la enzima. Las limitaciones de la genotipi cación se relacionan con la imposibilidad de detectar variantes alélicas poco fre- cuentes14-16. Dadas sus características, algunos estudios recomiendan la utilización de ambos métodos14, 16. En la presente serie se informan los resultados del método disponible en nuestro centro, la genotipi cación.
El genotipo de TPMT se asocia con el riesgo de EA, in- cluso mielosupresión, en pacientes que reciben tiopurinas. Los heterocigotas tienen un 30-60% de probabilidades de padecer mielosupresión moderada o grave, mientras que los que presentan dos alelos no funcionales invariable- mente desarrollan mielosupresión grave1, 3, 5, 6, 9, 14.
Las variantes genéticas de los alelos que codi can para la enzima pueden ser distintas en los individuos de una población. La mayoría presenta dos alelos normales, 3-14% es heterocigota, y el 0.3% presenta dos alelos no funcionales2-4, 11. Si bien en el presente estudio la frecuen- cia fue mayor a lo comunicado en la literatura (17.7% de heterocigotas y 2.2% de homocigotas), el resultado puede deberse al escaso número de personas estudiado.
Se han informado hasta 37 mutaciones relacionadas al genotipo de TPMT, pero cuatro alelos no funcionales (*2, *3A, *3B y *3C) son responsables de 80 a 95% de los casos de actividad disminuida de la enzima, con algunas diferencias en la frecuencia observada según la etnia5, 11.
La variante alélica no funcionante *3A es la más frecuente en caucásicos, mientras que *3C es más fre- cuente en africanos, afroamericanos y asiáticos, y hay poca información al respecto en población mestiza17. Un estudio realizado en 147 personas sanas halló que la variante alélica no funcional más prevalente en Argentina es la *3A seguida, en frecuencia, de los alelos *2 y *44. En la presente serie, el alelo más frecuentemente hallado fue el *2, seguido del *3A; la diferencia en el alelo más informado podría vincularse a una disímil proporción de caucásicos y mestizos entre las poblaciones estudiadas, al bajo número de la muestra de nuestro estudio o un posible sesgo en la selección de los pacientes al realizar la genotipi cación según la actividad enzimática baja o nula en el trabajo de Laróvere y col.4.
Dos de los tres que presentaron EA eran portadores de genotipo normal. En estudios previos se han comuni- cado EA en individuos con actividad enzimática normal, y podrían explicarse por la presencia de una infección viral concomitante, la administración simultánea de drogas con toxicidad medular, hepática o interacciones que aumenten los niveles séricos de AZA (como los 5-aminosalicilatos, naproxeno, infliximab y, con menor significancia clínica, alopurinol, furosemida y metotrexato)3, 11, 18, e incluso se ha descripto la presencia de alteraciones y polimorfismos en otros integrantes de la vía metabólica de las tiopurinas distintos del TPMT. No encontramos enfermedad clínica evidente que pueda explicar los EA ocurridos en los dos pacientes genotípicamente normales (Tabla 2). Respecto al uso de fármacos concomitantes, ambos se encontraban en tratamiento con bajas dosis de corticoides, y el que presentó leucopenia recibía concomitantemente hidroxicloroquina, fármaco ya relacionado con este EA que podría explicar su ocurrencia. Si bien habían recibido ciclofosfamida 36-100 días previos al momento del EA, es poco probable que su uso explique la mielotoxicidad, puesto que su vida media es de 7 horas y el menor recuento de granulocitos en sangre periférica ocurre 6-10 días luego de su administración19.
Aunque no podemos descartar la existencia de mutaciones de otras enzimas que actúan en la misma vía metabólica, ni la portación de otras variantes hipofuncionantes de TPMT no analizadas en el presente estudio, es poco probable que los EA que presentaron puedan deberse a estos motivos, puesto que las mutaciones no pesquisadas en este estudio son de baja prevalencia.
Respecto al que presentó hepatotoxicidad sin causa aparente, estudios recientes indican que la existencia de este EA podría estar ligada al uso de AZA más que al genotipo de TPMT20.
En la presente serie, si bien se detectaron ocho pacientes con genotipo heterocigota, sólo tres recibieron AZA y ninguno de ellos presentó EA (Tabla 3). Una posible explicación es que en los tres casos se utilizaban dosis de AZA ≤ 2 mg/kg/día, lo que representa una dosis 33% menor de la máxima utilizable, que coincide con las recomendaciones de ajuste de dosis en sujetos con genotipo heterocigota2. Posibles explicaciones del escaso número de EA encontrados fueron el tiempo de seguimiento insuficiente (comparado con un estudio de referencia)11, bajo número de sujetos estudiados y la concomitancia entre las características de la enfermedad y el EA. Ejemplo de esto es que dos de los heterocigotas presentaron enfermedad hepática confirmada por biopsia previa al inicio del tratamiento, sumado a leucopenia en uno de ellos. Por otro lado, se podría considerar la existencia de sujetos hipermetabolizadores que presentan alta actividad de la enzima entre los heterocigotas, según comunican Ansari y col.21.
Si bien se conoce que la prevalencia de individuos con genotipo homocigota mutado es baja, la ocurrencia de EA en este grupo suele implicar consecuencias graves para la salud, no siempre reversibles, con una eventual carga económica para el sistema de salud. En este caso, el único paciente que presentó genotipo homocigota mutado desarrolló, con dosis mínima recomendada para el tratamiento con AZA (1 mg/kg/día), el EA más grave de los registrados: aplasia medular. La toxicidad por fármacos, cuyo diagnóstico fue apoyado por biopsia, tuvo como forma de presentación neutropenia febril, por lo que conocer el estatus de actividad de la enzima resultaría un factor determinante en la seguridad de su administración.
La principal limitación de este trabajo es el escaso número de pacientes que iniciaron tratamiento con AZA entre aquellos a quienes se les había realizado el estudio genético. Hubiera sido interesante comparar las características clínicas y bioquímicas entre grupos según genotipo, pero el tamaño de la muestra no permitió realizar estadística.
La prevención y posiblemente los costos podrían justificar la genotipificación de la enzima previa al inicio del tratamiento en los individuos con indicación de AZA. El costo de tratar una aplasia medular es varias veces más alto que el costo de la genotipificación14, 22, 23. No obstante, sería conveniente realizar un estudio que incluya descripción de costos. La determinación del genotipo de TPMT no reemplaza al seguimiento clínico, el monitoreo hematológico y de las enzimas hepáticas en el paciente en tratamiento con tiopurinas; sin embargo, aportaría información valiosa para el diseño de la estrategia terapéutica.
Agradecimientos: A Darío Guevara, Alejandro Celía, María Florencia Martínez y María de los Ángeles Gargiulo por el análisis de los datos genéticos y bioquímicos, y a Adriana Scerbo, Susana Cesario y Lorena Suárez por la asistencia técnica.
Conflicto de intereses: Ninguno que declarar
Bibliografía
1. Relling MV, Gardner EE, Sandborn WJ, et al. Clinical pharmacogenetics implementation consortium guidelines for thiopurine methyltransferase genotype and thiopurine dosing. Clin Pharmacol Ther 2011; 89: 387-91.
2. DiPiero J, Teng K, Hicks JK. Should thiopurine methyltransferase (TPMT) activity be determined before prescribing azathioprine, mercaptopurine, or thioguanine? Cleve Clin J Med 2015; 82: 409-13.
3. Sahasranaman S, Howard D, Roy S. Clinical pharmacology and pharmacogenetics of thiopurines. Eur J Clin Pharmacol 2008; 64: 753-67.
4. Laróvere LE, de Kremer RD, Lambooy LH, De Abreu RA. Genetic polymorphism of thiopurine S-methyltransferase in Argentina. Ann Clin Biochem 2003; 40: 388-93.
5. Black AJ, McLeod HL, Capell HA, et al. Thiopurine methyltransferase genotype predicts therapy-limiting severe toxicity from azathioprine. Ann Intern Med 1998; 129: 716-8.
6. Schwab M, Schäffeler E, Marx C, et al. Azathioprine therapy and adverse drug reactions in patients with inflammatory bowel disease: impact of thiopurine S-methyltransferase polymorphism. Pharmacogenetics 2002; 12: 429-36.
7. Pons-Estel BA, Catoggio LJ, Cardiel MH, et al. The GLADEL multinational Latin American prospective inception cohort of 1,214 patients with systemic lupus erythemato sus: ethnic and disease heterogeneity among “Hispanics”. Medicine (Baltimore) 2004; 83: 1-17.
8. Ishioka S, Hiyama K, Sato H, et al. Thiopurine methyltransferase genotype and the toxicity of azathioprine in Japanese. Intern Med 1999; 38: 944-7.
9. Al-Judaibi B, Schwarz UI, Huda N, et al. Genetic predictors of azathioprine toxicity and clinical response in patients with inflammatory bowel disease. J Popul Ther Clin Pharmacol 2016; 23: e26-36.
10. Avallone EV, Pica R, Cassieri C, Zippi M, Paoluzi P, Vernia P. Azathioprine treatment in inflammatory bowel disease patients: type and time of onset of side effects. Eur Rev Med Pharmacol Sci 2014; 18: 165-70.
11. Connell WR, Kamm MA, Ritchie JK, Lennard-Jones JE. Bone marrow toxicity caused by azathioprine in inflammatory bowel disease: 27 years of experience. Gut 1993; 34: 1081-5.
12. Lee YJ, Hwang EH, Park JH, Shin J, Kang B, Kim S. NUDT15 variant is the most common variant associated with thiopurine-induced early leukopenia and alopecia in Korean pediatric patients with Crohn’s disease. Eur J Gastroenterol Hepatol 2016; 28: 475-8.
13. National Cancer Institute, Department of Health and Human Services (US); Common Terminology Criteria for Adverse Events. Version 4.0. En: https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf; consultado julio 2016.
14. Ford LT, Berg JD. Thiopurine S-methyltransferase (TPMT) assessment prior to starting thiopurine drug treatment; a pharmacogenomic test whose time has come. J Clin Pathol 2010; 63: 288-95.
15. Booth RA, Ansari MT, Loit E, et al. Assessment of thiopurine S-methyltransferase activity in patients prescribed thiopurines: A systematic review. Ann Intern Med 2011; 154: 814-23.
16. Graham V. Thiopurine methyltransferase phenotyping and genotyping in clinical practice. En: http://etheses.bham.ac.uk/738/1/Graham10MPhil.pdf; consultado mayo 2016.
17. Isaza C, Henao J, Lopez AM, Cacabelos R. Allelic variants of the thiopurine methyltransferase (TPMT) gene in the Colombian population. Methods Find Exp Clin Pharmacol 2003, 25: 423-9.
18. Van Aken J, Schmedders M, Feuerstein G, Kollek R. Prospects and limits of pharmacogenetics: the thiopurine methyl transferase (TPMT) experience. Am J Pharmacogenomics 2003; 3: 149-55.
19. Chabner BA, Amrein PC, Druker BJ, et al. Sección IV, Quimioterapia de las enfermedades neoplásicas, capítulo 51, Fármacos antineoplásicos. En: Brunton LL, Lazo JS, Parker KL, eds. Las bases farmacológicas de la terapéutica, 11ma edición. México: McGraw-Hill, 2007, p 1322-6.
20. Liu YP, Xu HQ, Li M, et al. Association between thiopurine S-methyltransferase polymorphisms and azathioprine-induced adverse drug reactions in patients with autoimmune diseases: A meta-analysis. PLoS ONE 2015; 10: e0144234.
21. Ansari A, Hassan C, Duley J, et al. Thiopurine methyltransferase activity and the use of azathioprine in inflammatory bowel disease. Aliment Pharmacol Ther 2002; 16: 1743-50.
22. Dubinsky MC, Reyes E, Ofman J, Chiou CF, Wade S, Sandborn WJ. A cost-effectiveness analysis of alternative disease management strategies in patients with Crohn’s disease treated with azathioprine or 6-mercaptopurine. Am J Gastroenterol 2005; 100: 2239-47.
23. Oh KT, Anis AH, Bae SC. Pharmacoeconomic analysis of thiopurine methyltransferase polymorphism screening by polymerase chain reaction for treatment with azathioprine in Korea. Rheumatology (Oxford) 2004; 43: 156-63.
