PALOMA OCAMPO, JUAN MANUEL DUARTE, RICARDO BARCIA, CECILIA ARÉVALO
Departamento de Medicina, VI Cátedra de Medicina, Hospital de Clínicas José de San Martin,
Universidad de Buenos Aires, Argentina
Resumen La diabetes mellitus ocurre en cerca del 10% de los pacientes con acromegalia y es secundaria a
la insulino resistencia causada por altos niveles de hormona de crecimiento. La cetoacidosis diabética ha sido descripta como una rara complicación de la acromegalia, resultado de una relativa deficiencia de insulina causada por exceso de hormona de crecimiento. Describimos el caso de un hombre de 38 años de edad que se presentó en el servicio de emergencias con historia de polifagia, polidispsia y poliuria con pérdida de peso de 6 semanas de evolución. Agregó en las últimas 48 horas náuseas, vómitos y dolor abdominal. A su ingreso, la glucosa plasmática fue 880 mg/dl, osmolaridad plasmática 368 mOsm/l, pH arterial 7.06 y bicarbonato plasmático 8.6 mEq/l. No tenía antecedentes personales ni familiares de diabetes. No se encontraron causas precipitantes de cetoacidosis. En el examen clínico presentaba características compatibles con acromegalia. La resonancia magnética nuclear mostró un macroadenoma pituitario y los dosajes de hormona de crecimiento fueron elevados. Luego de la resección del tumor, los niveles de glucosa plasmáticos resultaron normales. Este caso mostró la rara asociación de acromegalia con cetoacidosis diabética. La cirugía fue la modalidad definitiva de tratamiento.
Palabras clave: diabetes, acromegalia, cetoacidosis
Abstract Association between diabetic ketoacidosis and acromegaly. Diabetes mellitus occurs in nearly
10% of patients with acromegaly and is secondary to insulin resistance caused by high levels of growth hormone. Diabetes ketoacidosis has been described as a rare complication of acromegaly, resulting from a relative insulin deficiency caused by growth hormone excess. We described the case of a 38 year-old man who presented to the emergency room with a 6-week history of polydipsia, polyuria, polyphagia and weight loss. He also had nausea, vomiting and abdominal pain from two days before admission. His plasma glucose level was 880 mg/dl, plasma osmolarity 368 mOsm/l, arterial pH 7.06 and serum bicarbonate 8.6 mEq/l. At the clinical examination, he had features of acromegaly. Magnetic resonance imaging showed a pituitary macro adenoma and growth hormone dosages were abnormally high. After tumor removal, plasma glucose levels became normal. This case shows the rare association between diabetic ketoacidosis and acromegaly. Surgery, in this case, was the definite modality of treatment.
Key words: diabetes, acromegaly, ketoacidosis
Recibido: 22-VI-2017 Aceptado: 2-XI-2017
Dirección postal: Paloma Ocampo, Hospital de Clínicas José de San Martín, Av. Córdoba 2351 piso 10, 1120 Buenos Aires, Argentina
e-mail: palomaocammpo@hotmail.com
La relación entre la acromegalia y el trastorno del metabolismo de los glúcidos es conocida desde hace muchos años. Inicialmente se postuló que el desarrollo de diabetes en acromegalia estaría causado por algún factor glicotrópico segregado por la glándula pituitaria anterior, o por un desequilibrio entre los sistemas antagónicos vaso-insular y simpático-adrenal debido al crecimiento de los órganos, causado por el exceso de hormona de crecimiento1. Bernardo Houssay demostró el efecto diabetogénico de los extractos de hipófisis anterior y observó que la gravedad de la diabetes disminuía luego de la hipofisectomía anterior2.
Sin embargo, la relación entre acromegalia y cetoacidosis diabética aparece con poca frecuencia en la literatura3-9. Describimos el caso de un paciente adulto con acromegalia que desarrolló cetoacidosis diabética.
Caso clínico
Hombre de 38 años de edad que comenzó su enfermedad un mes y medio antes de la consulta con polidipsia, poliuria, polifagia y pérdida de peso. Dos días antes de su ingreso a nuestra institución presentó vómitos y dolor abdominal. No refirió fiebre, diarrea o constipación. En la evaluación inicial, los signos vitales fueron: presión arterial 100/70 mmHg, frecuencia respiratoria 18 por minuto, frecuencia cardíaca 110 latidos por minuto, temperatura axilar 36 °C, saturación de oxígeno 98%. El índice de masa corporal fue de 23 kg/m2. El paciente estaba lúcido, sin otros datos positivos en los exámenes cardiovascular, respiratorio, abdominal y neurológico. No se encontraron hallazgos clínicos compatibles con infección concomitante.
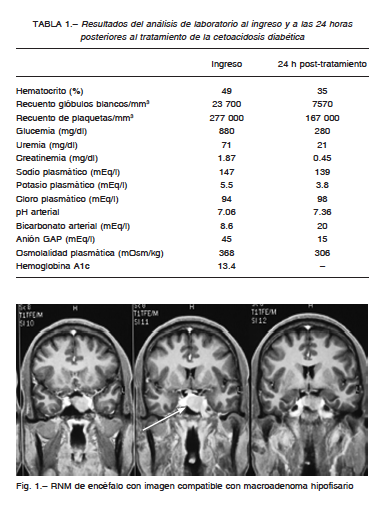
Llamó la atención el engrosamiento de pies y manos, la macroglosia y la prominencia de los arcos superciliares. Los datos del laboratorio al ingreso se muestran en la Tabla 1.
No se encontraron antecedentes personales ni familiares de diabetes, ni otro antecedente médico de relevancia.
Se realizó una ecografía abdominal, la cual no mostró anormalidades. Se cultivaron muestras de sangre periférica que no evidenciaron crecimiento bacteriano. Con el diagnóstico de cetoacidosis diabética se inició tratamiento con un plan de hidratación parenteral y la administración de insulina endovenosa. Evolucionó con rápida resolución del cuadro. Los datos de laboratorio posterior al tratamiento indicado se detallan en la Tabla 1.
El dosaje de hormona de crecimiento (GH) así como el factor de crecimiento insulínico (IGF-1) se encontraron aumentados (GH: 192 ng/ml, VN: hasta 8; IGF-1: 393 ng/ml, VN 109-284). Se evidenció un déficit en los ejes tirotropo y gonadotropo: tirotrofina 1.44 μUI/ml (VN: 0.35-4.94), triyodotironina 51 ng/ml (VN 58-159), tetrayodotironina 4.3 ng/ml (VN: 4.87-11.72), hormona luteinizante 1.1 mUI/ml (VN 1.5-9.3), hormona foliculoestimulante 4.1 mUI/ml (VN 13-70), testosterona total 1.81 ng/ml (VN 2.49-8.36). El resto de los parámetros endocrinos no presentaron alteraciones: prolactina 4.9 ng/ml (VN 2.1-8.7), cortisol sérico 21.2 μg/ml (VN 5.0-25).
El dosaje de péptido C fue de 3.5 ng/ml, encontrándose dentro de parámetros normales (VN: 1.1-5.0 ng/ml). El rastreo de anticuerpo anti GAD (glutámico ácido decarboxilasa) resultó negativo, mientras que el valor de hemoglobina glicosilada (HbA1C) fue de 13.4%.
Una resonancia magnética nuclear de encéfalo evidenció un aumento en el tamaño de la glándula hipófisis, de 22 x 20 mm, con una ligera laterización del tallo hipofisario hacia la derecha así como convexidad del techo selar y descenso del piso, sin afectación vascular. Presentó realce heterogéneo luego de la administración del contraste (Fig. 1).
La campimetría visual computarizada y la tomografía de coherencia óptica (OCT) resultaron normales.
El paciente fue dado de alta con 1 U/kg/día de insulina s.c y levotiroxina 100 µg/día. Más allá del diagnóstico de acromegalia, no se encontró ningún otro factor precipitante de la cetoacidosis. En las semanas posteriores evolucionó con reducción progresiva de los requerimientos de insulina. Se realizó exéresis transesfenoidal del macroadenoma hipofisario.
Luego de la cirugía no requirió ningún tratamiento hipoglucemiante. Los valores de glucemia en ayunas se mantuvieron por debajo de 100 mg/dl y el dosaje de HbA1C, 8 semanas después de la cirugía, fue de 5.5%. Los resultados de anatomía patológica confirmaron el diagnóstico de macroadenoma hipofisario secretor de hormona de crecimiento.
Discusión
La presentación clínica de este caso fue compatible con una cetoacidosis diabética, que se confirmó por los datos de laboratorio. No se demostró la presencia de un factor precipitante que pudiera explicar la leucocitosis a su ingreso. La misma se resolvió paralelamente al cuadro de cetoacidosis. Las características fenotípicas nos indujeron a sospechar el diagnóstico de acromegalia, confirmada por estudios de laboratorio y de neuroimágenes.
La acromegalia es una enfermedad relativamente rara en la población adulta y puede estar relacionada con resistencia a la insulina, intolerancia a la glucosa y diabetes mellitus tipo 2. El exceso de la hormona de crecimiento provoca un aumento de la glucogenólisis y de la gluconeogénesis hepática, y se produce una subutilización de la glucosa por los tejidos, debido a la inhibición en la síntesis de glucógeno y el déficit en la oxidación de la misma7. Además, se estimula la lipólisis con el consecuente aumento de los ácidos grasos plasmáticos y mayor insulinorresistencia7. Por otra parte, en pacientes con acromegalia, se evidencia una reducción de la concentración del receptor de insulina, un aumento de los niveles plasmáticos de insulina y una falla en la afinidad de la misma por su receptor10.
El desarrollo de cetoacidosis diabética es frecuentemente encontrado como presentación diagnóstica en diabéticos tipo 1 y mucho menos en diabéticos tipo 2, en general asociado a algún factor precipitante. La presentación inicial asociada a acromegalia es extremadamente rara.
En el paciente diabético, el desarrollo de cetoacidosis se produce debido a un déficit absoluto o relativo de insulina en relación a un incremento de las hormonas de contrarregulación4, que provoca una aceleración de la gluconeogénesis, la glucogenólisis y la reducción de la utilización de la glucosa a nivel periférico. Al mismo tiempo, el aumento de la lipólisis y la reducción de la lipogénesis, aumentan la producción de cuerpos cetónicos11.
Los pacientes con insulinorresistencia, incluyendo la DBT tipo 2, son relativamente resistentes al desarrollo de cetoacidosis. En aquellos con acromegalia, es probable que la prolongada hiperglucemia y la hiperlipidemia provoquen, debido a glucotoxicidad y lipotoxicidad sobre la célula beta pancreática, insulinopenia transitoria que desencadene el cuadro de cetoacidosis7.
Balasubramanyan y col.12 describieron los síndromes de diabetes propensos a la cetosis, los que se presentan con cetoacidosis diabética en ausencia de factores desencadenantes, sin el fenotipo típico de la diabetes tipo I autoinmune y con una evolución a la independencia de la insulina. Los clasificaron en A+β-, A+β+, A-β- y A-β+ según la presencia o ausencia de autoanticuerpos y presencia o ausencia de reserva funcional de las células β12. Los pacientes con acromegalia y cetoacidosis diabética pertenecerían a la categoría A-β+ del síndrome de diabetes con propensión a la cetosis8.
En el caso aquí descrito no se evidenció la presencia de anticuerpos anti-GAD y la reserva insulínica se encontró preservada. La evolución fue favorable, con requerimiento de dosis decrecientes de insulina antes de la cirugía y la completa resolución de su diabetes luego de realizada la exéresis del tumor.
En conclusión, la cetoacidosis diabética es una rara complicación asociada a acromegalia y estaría causada por el síndrome de diabetes con propensión a la cetosis, categoría A-β+, con déficit relativo de insulina debido al exceso de hormona de crecimiento.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Coggeshell C, Root HF. Acromegaly and diabetes mellitus. Endocrinology 1940; 26: 1-25.
2. De Herder WW. Heroes in endocrinology: Nobel Prizes. Endocr Connect 2014: R94-104.
3. Abrahamson MJ. Death form diabetes ketoacidosis after cessation of octreoctide in acromegaly. Lancet 1990; 336: 348-9.
4. Katz JR, Edwards R, Khan M, Conway GS. Acromegaly presenting with diabetic ketoacidosis. Postgrad Med J 1996; 72: 682-3.
5. Erem C, Ersöz HÖ, Ukinç K, et al. Acromegaly presenting with diabetic ketoacidosis, associated with retinitis pigmentosa and octroctide-induced bradycardia: a case report and review of the literature. Endocrine 2006; 30: 145-9
6. Chen YL, Wei CP, Lee CC, Chang TC. Diabetic ketoacidosis in a patient with acromegaly. J Formos Med Assoc 2007; 106: 788-91.
7. Ali O, Banerjee S, Kelly DF, Lee PDK. Management of type-2 diabetes mellitus associated with pituitary gigantism. Pituitary 2007; 10: 359-64.
8. Palakawong P, Arakaki R. Diabetic ketoacidosis in acromegaly: a case report. Endocr Pract 2012; 1-15. [Epub ahead of print]
9. Yoshida N, Goto H, Suzuli H, et al. Ketoacidosis as the initial clinical condition in nine patients with acromegaly: a review of 860 cases at a single institute. Eur J Endocrinol 2013; 169: 127-32.
10. Muggeo M, Saviolakis GA, Businaro V, et al. Insulin receptor on monocytes from patients with acromegaly and fasting hyperglycemia. J Clin Endocrinol Metab 1983; 56: 733-8.
11. Gosmarov AR, Kitabchi AE. Diabetic ketoacidosis. In: De Groot LJ, Chrousos G, Dungan K, et al. Ed. South Dartworth (MA): Endotext (internet). MDText.com, Inc; 2000 Apr 12.
12. Balasubramanyam A, Nalini R, Hampe C, Maldonado M. Syndrome of ketocis-prone diabetes mellitus. Endocr Rev 2008; 29: 292-302.
