CLAUDIA PALUMBO1, NORA NICOLACI2, ANDRÉS A. LA MANNA3, NATALIA BRANEK4, MARÍA N. PISSANO1
1Servicio de Nefrología, 2Servicio de Neurología, 3Servicio de Terapia Intermedia, 4Servicio de Laboratorio,
Clínica Ciudad de la Vida, Buenos Aires, Argentina
Resumen La diabetes insípida central es una enfermedad rara del hipotálamo y de la neurohipófisis, y muy
inusualmente se halla en el adulto con diabetes mellitus 2. Se manifiesta por un síndrome poliúrico polidípsico, que debe diferenciarse de la diabetes mellitus mal controlada. Ante la similitud de ambas entidades, y lo infrecuente de su coexistencia, se dificulta su sospecha. Se presenta el caso de un hombre de 72 años de edad, con diabetes mellitus 2 y pobre control de la misma (hiperglucemias de ayuno mayores a 180 mg/dl) que cursó un síndrome poliúrico de larga data. La hipernatremia y la osmolalidad plasmática elevadas, junto a una osmolalidad urinaria baja llevaron a la sospecha de diabetes insípida, que posteriormente se confirmó con la prueba de deshidratación y la administración de desmopresina s.c. Con un aumento del 61% de la osmolalidad urinaria calculada una hora post desmopresina s.c. fue diagnosticada como diabetes insípida del tipo central. La resonancia magnética nuclear mostró una mancha brillante con neurohipófisis normal, contribuyendo al diagnóstico de la forma idiopática.
Palabras clave: diabetes insípida central idiopática, diabetes mellitus tipo 2, adulto mayor
Abstract Association between central diabetes insipidus and type 2 diabetes mellitus. Central diabetes
insipidus is a rare disease of the hypothalamus and neurohypophysis. It is very unusually found in the adult with type 2 diabetes mellitus. It is manifested by a polydipsic polyuric syndrome, which must be distinguished from the poorly controlled type 2 diabetes mellitus. Given the similarity of both entities and the unusual nature of their coexistence, their suspicion is difficult. The case of a 72-year-old male with type 2 diabetes mellitus with poor insulin control (fasting hyperglycemia greater than 180 mg/dl) who had a long-standing polyuric syndrome is here presented. Hypernatremia and plasma osmolality elevated together with a low urinary osmolality led to the suspicion of diabetes insipidus, which was subsequently confirmed by the dehydration test and the administration of desmopressin sc. With 61% increase in the calculated urinary osmolarity one hour post desmopressin s.c., diabetes insipidus of central type was diagnosed. Nuclear Magnetic Resonance showed a bright spot with normal neurohypophysis, contributing to the diagnosis of the idiopathic form.
Key words: central diabetes insipidus, type 2 diabetes mellitus, elderly adult
Recibido: 1-VI-2017 Aceptado: 29-XII-2017
Dirección postal: Claudia Palumbo, Clínica Ciudad de la Vida, Av. Belgrano 2530,1096 Buenos Aires, Argentina
e-mail: clapalumbo@intramed.net
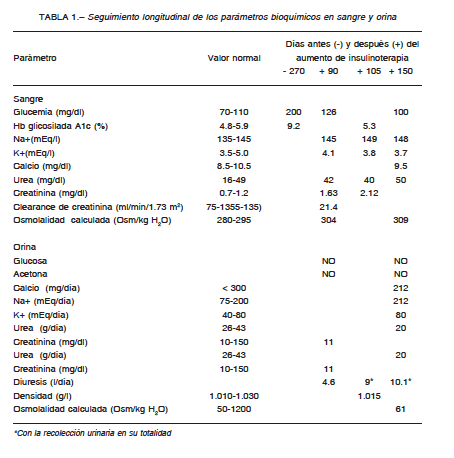
La diabetes insípida central (DIC) es una enfermedad rara del hipotálamo y de la hipófisis, debida a la deficiencia en la síntesis de arginina vasopresina de la eminencia media del hipotálamo y/o secreción de la neurohipofisis1, 2. Es clínicamente evidente cuando se destruyen del 80 al 90% de las neuronas magnocelulares de los núcleos supraóptico y paraventricular3, 4.Se caracteriza por síndrome poliúrico, hipostenuria, osmolalidad urinaria habitualmente menor a 100 mOsm/kg H2O1y densidad urinaria menor a 1005 g/l2. La poliuria y la polidipsia con apetencia por el agua fría son intensas1, 2. El diagnóstico se lleva a cabo mediante la clínica, el laboratorio, la prueba de deshidratación, distinguiendo de otros síndromes poliúricos; y los estudios por imagen de resonancia magnética nuclear (RMN) del hipotálamo e hipófisis1, 3-5. Las hiperglucemias no controladas, mayores a 180 mg/dl, de la diabetes mellitus (DM)se manifiestan con poliuria, y polidipsia. La poliuria es osmótica, con osmolalidad urinaria mayor a 300 mOsm/kg H2O, y densidad urinaria mayor a 1015 g/l2. Estos parámetros la diferencian de las poliurias acuosas y de la diabetes insípida2.
Caso clínico
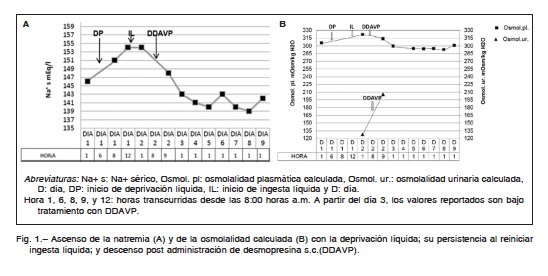
Hombre de 72 años que concurrió al consultorio de nefrología por presentar poliuria de 4 años de evolución, nicturia, apremio miccional e incontinencia urinaria. Tenía como antecedentes diabetes mellitus tipo 2 (DM2) desde hacía 8 años, hipertensión arterial, dislipemia y obesidad. Las transgresiones alimentarias y el mal control de su diabetes fueron constantes en toda su evolución. Entre 9 y 3 meses antes de la consulta, los exámenes de laboratorio mostraban glucemias de ayuno mayores a 180 mg/dl (182 a 224mg/dl) y la hemoglobina glicosilada a1c llegaba al 9%, junto con aumento de peso. En esa oportunidad se duplicó la dosis diaria de insulina para normalizar sus valores. La medicación recibida incluía insulina detemir 40 U/día, lispro 42 U/día, enalapril 10 mg/día, amlodipina 10 mg/día y atorvastatina 10 mg/día. Tenía como antecedentes familiares, el padre y hermano con DM2. Presentaba anemia normocítica, normocrómica, hipoproliferativa, que fue tratada con eritropoyetina 10 000 U s.c./semana y sulfato ferroso 200 mg vía oral por día. Estuvo en psicoterapia por depresión hasta un año atrás, cuando la abandonó. Refirió carcinoma prostático dos años atrás, que fue tratado con resección transuretral y radioterapia tridimensional conformada sobre próstata, con una dosis de 7600 cGy en 2 meses, y acetato de triptorelina, 3.75 mg i.m./mes. Se realizó flujometría que informó disminución del llenado vesical por hipotonía del detrusor. Presentó análisis de laboratorio con diabetes descontrolada, y otro posterior con insuficiencia renal (Tabla 1). En un segundo y minucioso interrogatorio se desprendió que presentaba sed intensa, tomaba jarras de agua helada, y su cónyuge mencionó que descartaba orina en la recolección. Los siguientes análisis mostraron hipernatremia, osmolalidad plasmática elevada, osmolalidad urinaria baja, volumen urinario elevado y diabetes controlada (Tabla 1). Cuatro meses después, se internó para su diagnóstico. Con la vigilancia estricta de la ingesta líquida por personal de enfermería y cónyuge, realizó la prueba de deprivación de agua (prueba de Miller)1. Se interrumpió a las 6 h por sed intolerable e hipernatremia (Fig. 1A). La densidad urinaria inicialmente de 1000 g/l aumentó a 1005g/l en ese lapso. Su peso corporal descendió 1.5 kg. La diuresis fue de 358 ml/hora. Reinició la ingesta líquida, y se suministró una dosis estándar de 4 μg de acetato de desmopresina (DDAVP) s.c. Una hora después aumentaron la osmolalidad urinaria calculada (Fig. 1 B), y la densidad urinaria a 1010 g/l; descendieron la osmolalidad plasmática calculada y la natremia, continuando así en los días siguientes (Fig.1A y B). La diuresis disminuyó a 1.1 l/día y resolvió la incontinencia urinaria. La RMN de hipófisis y cerebro sin contraste resultó normal. En el plano sagital y secuencia T1 del tallo pituitario central (neurohipófisis) con calibre habitual, presentó señal hiperintensa fisiológica, la “mancha brillante”. El contraste con gadolinio IV no mostró realces patológicos. Se externó con DDAVP 0.2 mg/día vía oral. Ambulatoriamente realizó una segunda RMN que confirmó lo anterior. Estudios endocrinológicos: 200 días después de la prueba se hallaron valores de hormona antidiurética (HAD)< 0.5 pg/ml, somatotrofina 0.06 ng/ml, luteinizante < 0.1 mUI/ml, prolactina 17.50 ng/ml, adrenocorticotrofina 63.0 pg/ml, cortisol 17.50 μg/dl, enzima convertidora de angiotensina I < 3 U/l, TSH 4.30 μUI/ml, T3 107 ng/dl, T4 1.10 ng/dl. Setenta y cinco días después de estos análisis se determinó HAD sin la dosis matutina de DDAVP
vía oral, y la osmolalidad plasmática, siendo los valores 0.9 pg/ml y 340 mOsm/kg H2O, respectivamente. En ese año, un estudio ecográfico mostró riñones de tamaño normal y forma conservada, y la vejiga de forma triangular, simétrica, y con paredes irregulares de lucha. Al año siguiente la IgG4 fue de 0.48 g/l (VR 0.08-1.40g/l).
Discusión
En una aproximación a los algoritmos propuestos para el diagnóstico diferencial de las poliurias, se descartó poliuria osmótica no electrolítica y por electrolitos a través de análisis de laboratorio apropiado2. Luego, se realizó una prueba de deshidratación para diferenciar diabetes insípida de polidipsia primaria (psicógena)1, 3, 4, 6, condición posible por su antecedente de desorden alimentario7. Durante la prueba mostró densidad urinaria baja con un leve aumento posterior, y su peso corporal descendió menos del 5%, no asegurando un estímulo adecuado para la liberación de HAD necesario para el diagnóstico1, 6. Sin embargo, la elevación de la natremia por encima de 150 mEq/l y la sintomatología referida por el paciente permitieron sospechar diabetes insípida4, 6, que fue confirmada con la respuesta a la administración de DDAVP. Debido a que la osmolalidad urinaria calculada aumentó el 61%, una hora luego de la administración de DDAVP, se diagnosticó diabetes insípida central total, según se describe que si ésta es > al 9%, en el lapso de 30 a 60 minutos pos DDAVP es diagnóstico de la forma central4, 8 y si supera el 50%, es total1, 2, 8. La osmolalidad urinaria baja en relación a la plasmática1, los niveles absolutos de HAD aislados bajos2 y en relación a la osmolalidad plasmática (HAD inadecuada para la osmolalidad plasmática) reafirmaron el diagnóstico2, 6. Las imágenes de RMN descartaron lesiones en la región selar como posible causa y, además, mostraron una señal hiperintensa de la neurohipófisis, presente en la mayoría de los adultos y niños sanos2, 4, 5, 9 y en el 22% de los casos de DIC idiopática8. Los valores séricos bajos de enzima convertidora de angiotensina I y el perfil normal de hormonas secretadas por la anterohipófisis permiten descartar a sarcoidosis y panhipopituitarismo como posibles causales de la diabetes insípida central8, 10, 11. Muchos casos de DIC idiopáticas se han podido atribuir a la atrofia de la neurohipófisis, o de los núcleos supra óptico y para ventricular12, a procesos de autoinmunidad1, 3, 6, 8, 12, y a causas genéticas12. Las causas genéticas son autosómicas dominantes familiares y de inicio en la niñez o al nacer3. Se ha descripto una mutación de novo en el gen de HAD, en la región que codifica la neurofisina II, que está asociada con el tamaño normal del tallo hipofisario3, 12.
El paciente no tenía las características de los procesos autoinmunes, que se presentan con engrosamiento del tallo hipofisario en la RMN, historia de enfermedades autoinmunes (diabetes mellitus tipo I, entre otras), y edad joven8, 11. Si bien la enfermedad pituitaria relacionada a la IgG4 es hallada más frecuentemente en hombres, la determinación sérica de IgG4 en la misma aumenta y existe agrandamiento del tallo pituitario por RMN11, ambos rasgos ausentes en nuestro caso.
Se conjeturó la posibilidad de que la asociación de DM y DIC sin causa aparente en el adulto, sea una alteración genética en común, a partir del hallazgo de ambas diabetes surgidas en la adultez de dos hermanos13. La DIC y la DM2 descontrolada tienen similar presentación clínica14. En un paciente con trastorno alimentario se suele considerar esta última. Las hiperglucemias no controladas y la inadecuada recolección urinaria dificultan la sospecha de DIC, y más aún por su infrecuencia, puede transcurrir mucho tiempo sin diagnóstico.
La DIC tiene muy baja tasa de prevalencia, 23 pacientes por cada 100 000 habitantes, y su incidencia anual es de 3 a 4 pacientes por 100 000 habitantes15, siendo aún menor la forma idiopática, 20%2 a 52% de los casos de DIC3-5, 9, y más rara es su coexistencia con la DM2. Muy pocos casos (diez) se han publicado sobre la coexistencia de DIC idiopática con DM2 en adultos. Algunos de esos casos publicados se acompañaban de otros síndromes como el de Klinefelter; Albright, o asma13. En uno hubo simultaneidad diagnóstica de ambos trastornos13. En el año 2006 se calculó que más de 100 personas en los EE.UU. padecerían de ambos trastornos14.
En la Argentina no hay estadísticas publicadas de DIC, ni de casos de coexistencia de ambas diabetes. Solo se cuentan con las cifras de DM2 en el adulto que arrojó la “III encuesta nacional de factores de riesgo para enfermedades no transmisibles” del año 2013.
Concluimos que la presentación de poliuria y polidipsia en un paciente con DM2 establecida, debe ponernos en consideración los diagnósticos diferenciales del síndrome poliúrico, y dirigir un minucioso examen psicofísico y bioquímico apropiados, teniendo en cuenta hasta las entidades y asociaciones más inusuales.
Agradecimientos: A las autoridades de la Obra Social de Gráficos, Clínica Ciudad de la Vida, por la ayuda financiera para solventar el pago de la publicación.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Morrison G, Singer I. Hyperosmolal states. En: Narins RG (ed) Maxwell and Kleeman’s. Clinical Disorders of Fluid and Electrolyte Metabolism. USA: McGraw-Hill Education (ISE Editions), 1994, p 617-58.
2. Godoy DA, Álvarez E, Campi V, Soler C, MasottI L, DI Napoli M. Enfoque práctico para el diagnóstico y tratamiento de los estados poliúricos en pacientes con injuria cerebral aguda. Rev Med Chile 2013; 141: 616-25.
3. Di Iorgi N, Napoli F, Allegri AEM, et al. Diabetes insipidus: diagnosis and management. Horm Res Paediatr 2012; 77: 69-84.
4. Català Bauset M, Gilsanz Peral A, Tortosa Henzi F, et al. Guía clínica del diagnóstico y tratamiento de los trastornos de la neurohipofisis. Endocrinol Nutr 2007; 54:23-33.
5. Fenske W, Allolio B. Current state and future perspectives in the diagnosis of diabetes insipidus: a clinical review. J Clin Endocrinol Metab 2012; 97: 3426-37.
6. García-García EJ. Diabetes Insípida. Protoc Diagn Ter Pediatr 2011; 1:1: 44-53.
7. Singh S, Padi MH, Bullard H, et al. Water intoxication in psychiatric patients. Br J Psychiatry 1985; 146: 127-31.
8. Pivonello R, De Bellis A, Faggiano A, et al. Central diabetes insipidus and autoimmunity: relationship between the occurrence of antibodies to arginine vasopressin-secreting cells and clinical, immunological, and radiological features in a large cohort of patients with central diabetes insipidus of known and unknown etiology. J Clin Endocrinol Metab 2003; 88: 1629-36.
9. Maghnie M, Cosi G, Genovese E, et al. Central diabetes insipidus in children and young adults. N Engl J Med 2000; 343: 998-1007.
10. Iannuzzi MC, Rybicki BA, Teirstein AS. Sarcoidosis. N Engl J Med 2007; 357: 2153-65.
11. Haraguchi A, Era A, Yasui J, et al. Putative IgG4-related pituitary disease with hypopituitarism and/or diabetes insipidus accompanied with elevated serum levels of IgG4. Endocrine J 2010; 57: 719-25.
12. MakaryusAN, Mc Farlane SI. Diabetes insipidus: diagnosis and treatment of a complex disease. Cleve Clin J Med 2006; 73: 65-71.
13. ShinHJ, KimJH, YiJH, HanSW. Polyuria with the concurrent manifestation of central diabetes insipidus (CDI) &type 2 diabetes mellitus (DM). Electrolyte Blood Press 2012; 10: 26-30.
14. Akarsu E, Buyukhatipoglu H, Aktaran S, Geyik R. The value of urine specific gravity in detecting diabetes insipidus in a patient with uncontrolled diabetes mellitus. Urine specific gravity in differential diagnosis. J Gen Intern Med 2006; 21: C1-2.
15. Schroeder VJ, Rittig S, Nørgaard JP. National surveillance of central diabetes insipidus (CDI) in Denmark: results from 5 years registration of 9309 prescriptions of desmopressin to 1285 CDI patients. J Clin Endocrinol Metab 2014; 99: 2181-7.
– – – –
[Watson] “I am afraid” said I, “that the facts are so obvious that you will find little credit to be gained by this case”.
[Holmes] “There is nothing more deceptive than an obvious fact”, he answered laughing.
[Watson] “Me temo”, dije yo, “que los hechos son tan obvios que usted ganará poco crédito de este caso”.
[Holmes] “No hay nada más engañoso que un hecho obvio”, respondió riendo.
