RICARDO A. GÓMEZ TEJADA1, CORA G. LEGARRETA1, JUAN IGNACIO ENGHELMAYER1,
MILAGROS DIANTI1, SILVANA ACUÑA1, GLORIA OLMEDO2
1División Neumonología, Hospital de Clínicas José de San Martín, 2Consultoría en Patología Pulmonar,
Buenos Aires, Argentina
Resumen En una serie de nueve pacientes con diagnóstico histopatológico de neumonitis por hipersensibilidad,
se revisaron en forma retrospectiva la historia clínica, los factores de exposición, las pruebas de función pulmonar y las tomografías computarizadas de tórax. La función pulmonar evidenció principalmente compromiso restrictivo con disminución de la difusión de monóxido de carbono. Las tomografías de tórax mostraron patrones fibróticos en la mayoría de los casos; áreas de vidrio esmerilado con patrón en mosaico y áreas de consolidación en el resto. Pudo detectarse exposición a antígenos aviarios, granos de cereales y acondicionadores de aire contaminados con esporas de hongos y bacterias, en dos tercios de los casos. Dado que no existen características únicas que permitan diferenciar la neumonitis por hipersensibilidad de otras enfermedades del intersticio pulmonar, se requiere de un alto índice de sospecha clínica y de una detallada búsqueda de exposición ambiental que deberán complementarse con los datos clínicos, radiológicos y de anatomía patológica para llegar al diagnóstico.
Palabras clave: neumonitis por hipersensibilidad, diagnóstico de neumonitis por hipersensibilidad, neumonía intersticial usual, fibrosis pulmonar idiopática
Abstract Hypersensitivity pneumonitis. A series of nine cases with surgical lung biopsy. In a series of
nine patients with histopathological diagnosis of hypersensitivity pneumonitis, we retrospectively evaluated clinical data, exposure related factors, pulmonary function tests and chest computed tomography scans. A restrictive abnormality with reduction of diffusion capacity for carbon monoxide was mainly found. Chest scans showed fibrotic patterns in most cases; ground glass attenuation areas with mosaic pattern and consolidation in the rest. Exposure to avian antigens, cereal grains and air conditioners contaminated with fungi yeasts and bacteria, were suspected from clinical data in two-thirds of the cases. Since there are no unique features that allow differentiation from other interstitial lung diseases, a high clinical suspicion is required and a careful search of environmental exposure to possible antigens is needed that, together with clinical, radiological and pathological data, may lead to diagnosis.
Key words: hypersensitivity pneumonitis, diagnosis of hypersensitivity pneumonitis, usual interstitial pneumonia, idiopathic pulmonary fibrosis
Recibido: 2-VIII-2017 Aceptado: 7-XI-2017
Dirección postal: Ricardo A. Gómez Tejada, Ramos Mejía 1050 5° A, 1405 Buenos Aires, Argentina
e-mail: ryagomeztejada@gmail.com
La neumonitis por hipersensibilidad (NH) o alveolitis alérgica extrínseca es un síndrome pulmonar complejo resultante de la inhalación repetida y sensibilización a diversos antígenos en aerosol presentes en el ambiente laboral, doméstico o recreativo. La evolución clínica y su forma de presentación son heterogéneas y están relacionadas con la intensidad y la duración de la exposición al agente causal, al tipo de antígeno presente y a factores propios del huésped, como la susceptibilidad genética. La prevalencia entre las personas expuestas varía ampliamente según las distintas series y países1. La dificultad en la detección del antígeno responsable y el diagnóstico diferencial con otras enfermedades del intersticio pulmonar, especialmente con la fibrosis pulmonar idiopática, hacen difícil el diagnóstico, incluso para los especialistas.
En esta serie de nueve pacientes con diagnóstico anátomo-patológico de NH, se revisaron los datos clínicos, los antecedentes sobre la exposición a diversos antígenos, las pruebas de función pulmonar y las imágenes de las tomografías computarizadas de tórax.
Casos clínicos
Fueron evaluados nueve pacientes con diagnóstico histopatológico de NH en la biopsia pulmonar quirúrgica por videotoracoscopía. La mediana de edad fue 64 años (rango: 51-68); cuatro mujeres y cinco varones. El principal motivo de consulta fue disnea progresiva (8/9), tos (4/9) y sibilancias intermitentes (3/9). Ninguno se hallaba febril al momento de la consulta; un paciente perdió peso; uno era fumador activo al momento del diagnóstico. En el examen físico, se auscultaban rales inspiratorios tipo “velcro” (4/9) y rales húmedos y sibilancias (3/9).
Tres pacientes tenían espirometría normal, dos con patrón obstructivo y cuatro con patrón restrictivo. La mediana de capacidad vital forzada (FVC) fue 2.800 l (cuartilos: 2.520-3.730 l); mediana de FVC % predicho igual a 79% (cuartilos: 74-87%).
La mediana de capacidad pulmonar total (TLC) fue 4.470 l (cuartilos: 3.800-4.970); la mediana de TLC en términos porcentuales fue 75.5 % del predicho (cuartilos: 69.0-84.3%). La TLC se encontraba disminuida por debajo del 80% del valor esperado en los seis pacientes medidos. En estos mismos, se registró disminución de la difusión de monóxido de carbono (DLCO) por debajo del 80% del valor predicho en 5 de 6. La mediana de DLCO fue 13.9 ml/min/mmHg (cuartilos: 10.8-21.8) y la mediana de DLCO% del valor predicho resultó 55% (cuartilos: 43.5-70.3).
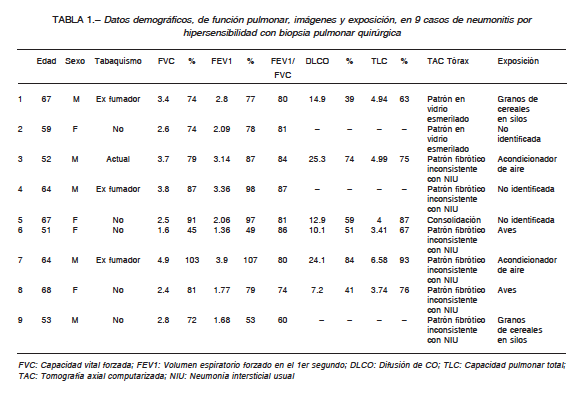
Los hallazgos tomográficos fueron: a) patrón fibrótico inconsistente con neumonía intersticial usual en 6 pacientes; b) áreas de vidrio esmerilado con patrón en mosaico bilateral en 2 casos; c) áreas de consolidación compatibles con neumonía en organización en el caso restante. Se resumen los datos en la Tabla 1.
Se obtuvo resultado del lavado broncoalveolar (BAL) solamente en dos pacientes, uno de ellos presentaba 29% de linfocitos y el otro, un patrón no-característico. Las biopsias quirúrgicas de pulmón por videotoracoscopía fueron analizadas; cuatro pacientes tenían biopsias de más de un lóbulo. En todos los casos, las lesiones predominaban en las zonas centrolobulares, donde se observó un infiltrado inflamatorio mononuclear que rodeaba los bronquiolos y se extendía en menor o mayor extensión hacia el parénquima vecino. Se encontraron granulomas histiocitarios laxos con alguna célula gigante multinucleada o también células gigantes aisladas y dispersas en el intersticio en cinco pacientes. En un caso se encontró, además de los infiltrados, exudado fibrinoso en organización intraalveolar como signo de reagudización.
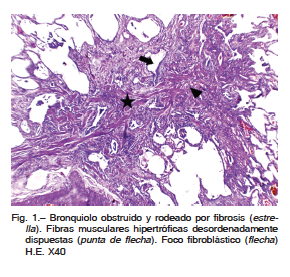
Cinco pacientes presentaban fibrosis peribronquiolar, a veces con modificación de la estructura, obliteración de la luz de la vía aérea y proliferación de músculo liso (Fig. 1).También pudo observarse extensión y proliferación del epitelio bronquiolar hacia los alveolos vecinos a través de los canales de Lambert (proliferación bronquiolar o “lambertosis”) lo cual es evidencia de lesión de la pequeña vía aérea. En tres pacientes, las zonas de fibrosis eran más extensas, y se prolongaban a través del parénquima uniendo más de un bronquiolo o extendiéndose entre el bronquiolo y las zonas de áreas de fibrosis subpleural (“bridging fibrosis”).
Hubo datos relevantes de exposición a antígenos aviarios y agentes microbianos en seis casos. Dos pacientes presentaban exposición frecuente a aves y dos tenían contacto laboral regular con granos de cereales en silos; en los dos restantes, existía exposición potencial a esporas de hongos y bacterias que contaminaban acondicionadores de aire.
Discusión
En la evaluación diagnóstica de la NH2, deben considerarse los siguientes elementos: a) presencia de una enfermedad intersticial pulmonar con o sin síntomas generales (fiebre o pérdida de peso); b) reconocimiento de un antígeno inhalado al que el individuo está sensibilizado y es reactivo; c) un resultado positivo en la prueba de precipitinas séricas a un antígeno incitante (ésta puede señalar exposición, pero no significa enfermedad cuando
falta el compromiso clínico); d) alveolitis linfocítica en el BAL; e) infiltrado intersticial linfoplasmocitario, compromiso bronquiolo-céntrico con bronquiolitis celular y granulomas pobremente formados en el examen histológico, con grados variables de fibrosis en las formas crónicas.
La identificación del factor de exposición es la verdadera clave diagnóstica. En la práctica, obliga a realizar un interrogatorio minucioso sobre posible exposición en el ambiente laboral o doméstico, así como también en cualquier lugar visitado frecuentemente por el paciente; esto exige dedicar tiempo para obtener datos en las consultas con el paciente o sus familiares. El uso de un cuestionario estandarizado podría ser de mucha utilidad para identificar exposiciones que, de otra manera, podrían no ser reconocidas; sin embargo, no existen aún cuestionarios que hayan sido validados para su uso rutinario3. A pesar de una búsqueda exhaustiva, el antígeno responsable puede no llegar a identificarse hasta en más del 50 % de los casos en las formas crónicas4, 5; en estos pacientes el comportamiento clínico de la enfermedad puede ser refractario al tratamiento y ser similar al de la fibrosis pulmonar idiopática.
En el paciente 8, la exposición a antígenos aviarios fue detectada luego de varias entrevistas y por referencia indirecta de un familiar. La exposición a antígenos aviarios ha sido señalada recientemente por Morell y col.6. En un estudio prospectivo, en un grupo de pacientes que tenían diagnóstico de fibrosis pulmonar idiopática, acorde a las guías internacionales, la observación durante un período prolongado con análisis sucesivos y cuestionarios dirigidos para identificar exposición oculta a diversos antígenos, permitió determinar que casi la mitad de los pacientes tenían en realidad NH crónica. La exposición a antígenos aviarios, presentes en edredones y almohadas confeccionados con plumas, era la más frecuentemente observada.
Un interrogatorio detallado sobre los antecedentes laborales permitió sospechar la presencia de NH en los pacientes 1 y 9, quienes presentaban exposición a granos de cereales en silos, la forma comúnmente conocida como pulmón de granjero. En los pacientes 3 y 7 existía exposición a esporas de hongos y bacterias que contaminaban acondicionadores de aire.
En un tercio de los casos, no se pudo identificar exposición a un antígeno. Si bien –como ya fuera mencionado– no se logra encontrar el antígeno desencadenante en un porcentaje importante de los casos4, 5, el carácter retrospectivo de esta serie agrega una limitación al respecto.
La clásica división de la NH en aguda, subaguda y crónica, utilizada frecuentemente, tiene poco valor pronóstico y es difícil de implementar en la práctica; por este motivo, recientemente se ha propuesto una nueva clasificación basada en la correlación clínica-radiológica-patológica: aguda/inflamatoria y crónica/fibrótica. Esta nueva clasificación permite predecir el comportamiento clínico de la enfermedad y por lo tanto, guiar el tratamiento3. La NH aguda/inflamatoria presenta síntomas de menos de 6 meses de evolución, es frecuentemente reversible y tiene buen pronóstico si se evitan nuevas exposiciones; la NH crónica indica un curso prolongado o repetitivo de NH aguda más allá de los 6 meses, presentando cambios fibróticos en la tomografía de tórax o en la biopsia pulmonar y tiende a progresar a pesar de la evitación del antígeno y del tratamiento. Algunos pacientes con NH crónica pueden tener síntomas agudos intermitentemente en el curso de la enfermedad y presentar una combinación de cambios radiológicos y/o histopatológicos inflamatorios activos y crónicos simultáneamente. De la misma manera que la fibrosis pulmonar idiopática, la NH crónica puede ocasionalmente complicarse con un cuadro de exacerbación aguda con deterioro respiratorio grave2, 3.
Los hallazgos tomográficos demostraron patrones fibróticos en la mayoría de los casos y, con menor frecuencia, áreas de vidrio esmerilado, patrón en mosaico y consolidación. El principal diagnóstico diferencial de los patrones fibróticos es la fibrosis pulmonar idiopática, cuyas imágenes típicas corresponden a la neumonía intersticial usual. Ésta se caracteriza por presentar alteraciones reticulares, panalización con o sin bronquiectasias por tracción, predominantemente subpleurales y basales. En nuestros pacientes, los hallazgos fueron inconsistentes con dicho patrón: las anormalidades predominaban en los lóbulos superiores y además se agregaron áreas extensas de vidrio esmerilado y consolidación parenquimatosa7.
Las alteraciones histopatológicas de la NH en su fase activa (inflamatoria) incluyen la característica tríada de lesiones: infiltrado intersticial linfoplasmocitario en alvéolos cercanos a los bronquiolos, infiltrado inflamatorio en el epitelio y pared bronquiolar (bronquiolitis celular) y granulomas pobremente formados con escasas células gigantes multinucleadas; estas últimas pueden presentar espacios aciculares de colesterol en el citoplasma y, en algunas ocasiones, pueden encontrarse solamente en forma aislada en el intersticio alveolar sin formación de granulomas8, 9. En las formas que evolucionan hacia la fibrosis, ésta puede adoptar características histológicas variables: 1) fibrosis peribronquiolar con o sin presencia de proliferación bronquiolar (“lambertosis”); 2) fibrosis irregular en bandas (“bridging fibrosis”); 3) una fibrosis con patrón histológico de neumonía intersticial usual o una fibrosis más uniforme, tal como se observa en la neumonitis intersticial inespecífica en etapa fibrótica10, 11.
En esta serie, el cuadro histopatológico permitió observar entre las alteraciones previamente descriptas, un patrón de neumonitis intersticial inespecífica, un patrón de fibrosis peribronquiolar y un patrón “símil neumonía intersticial usual” con lesiones más extensas8-11. Estas características histológicas plantean el diagnóstico diferencial con el patrón de neumonía intersticial usual de la fibrosis pulmonar idiopática3, 10-12. Muy sugerente es la disposición en “bandas” o “bridging” de la fibrosis que se observa en la neumonitis por hipersensibilidad10. Los granulomas se presentaron solo en tres de los casos; a diferencia de la fase inflamatoria, en las formas crónicas los granulomas pueden ser aislados o estar ausentes por completo8-10.
Como limitaciones de esta serie, señalamos no contar con determinaciones de precipitinas séricas contra los antígenos responsables de la enfermedad. Si bien éstas no son específicas e implican solamente exposición, en el contexto clínico apropiado su presencia apoya el diagnóstico.
Solo se dispuso de BAL en dos casos. La patente clásica con predominio linfocitario se halló en el paciente 8. En el caso 9, los hallazgos no fueron característicos. Si bien la especificidad diagnóstica del BAL en las enfermedades intersticiales es controvertida, la presencia de una alveolitis linfocítica es frecuentemente encontrada en estos casos y es uno de los elementos que contribuyen al diagnóstico2, 13. Más del 80% de los pacientes con NH crónica tienen recuentos de linfocitos mayores al 20% en el BAL, dato de particular importancia para el diagnóstico diferencial con la fibrosis pulmonar idiopática cuando la presentación clínica es símil neumonía intersticial usual14.
La NH es de difícil diagnóstico debido a la semejanza con otras enfermedades intersticiales como la fibrosis pulmonar idiopática en la forma crónica y a la presencia, en muchos casos, de factores ambientales desconocidos. La historia de exposición al antígeno, la presencia de anticuerpos séricos contra el antígeno responsable, los datos clínicos y radiológicos y la presencia de linfocitosis en el BAL, son elementos indispensables para llegar al diagnóstico.
Si el diagnóstico clínico continuara siendo incierto, debería considerarse la realización de una biopsia pulmonar broncoscópica o quirúrgica. La biopsia transbronquial convencional con fórceps puede mostrar en algunos casos las características histopatológicas de la NH2 y puede tomarse en el mismo procedimiento inmediatamente luego del BAL3. La biopsia quirúrgica de pulmón o la criobiopsia transbronquial, actualmente en desarrollo, permitirían obtener muestras de parénquima pulmonar de mayor tamaño aumentando el rédito diagnóstico; la decisión de utilizar uno u otro método dependerá de la condición clínica del paciente para tolerar el procedimiento y de la experiencia de cada centro2, 3.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Selman M, Pardo A, King TE. Hypersensitivity pneumonitis. Insights in diagnosis and pathobiology. Am J Respir Crit Care Med 2012; 1864: 314-24.
2. Spagnolo P, Rossi G, Cavazza A, et al. Hypersensitivity pneumonitis: a comprehensive review. J Investig Allergol Clin Immunol 2015; 25: 237-50.
3. Vasakova M, Morell F, Walsh S, Leslie K, Raghu G. Hypersensitivity pneumonitis: Perspectives in diagnosis and management. Am J Respir Crit Care Med 2017; 196: 680-9.
4. Salisbury ML, Myers JL, Belloli EA, Kazerooni EA, Martinez FJ, Flaherty KR. Diagnosis and treatment of fibrotic hypersensitivity pneumonia. Where we stand and where we need to go. Am J Respir Crit Care Med 2016; 196: 690-9.
5. Fernández Pérez ER, Swigris JJ, Forssén AV, et al. Identifying an inciting antigen is associated with improved survival in patients with chronic hypersensitivity pneumonitis. Chest 2013; 144: 1644-51.
6. Morell F, Villar A, Montero MA, et al. Chronic hypersensitivity pneumonitis in patients diagnosed with idiopathic pulmonary fibrosis: a prospective case-cohort study. Lancet Respir Med 2013; 1: 685-94.
7. Wells AU. The revised ATS/ERS/JRS/ALAT diagnostic criteria for idiopathic pulmonary fibrosis (IPF) – practical implications. Respir Res 2013; 14 (Suppl 1): S2.
8. Barrios RJ. Hypersensitivity pneumonitis: histopathology. Arch Pathol Lab Med 2008; 132: 199-203.
9. Takemura T, Akashi T, Ohtani Y, Inase N, Yoshizawa Y. Pathology of hypersensitivity pneumonitis. Curr Opin Pulm Med 2008; 14: 440-54.
10. Churg A, Bilawich A, Wright JL. Pathology of chronic hypersensitivity pneumonitis. What is it? What are the diagnostic criteria? Why do we care? Arch Pathol Lab Med 2017 doi:10.5858/arpa.2017-0713- RA. [Epub ahead of print]
11. Miller R, Allen TC, Barrios RJ, et al. Hypersensitivity pneumonitis: a perspective from members of the Pulmonary Pathology Society. Arch Pathol Lab Med 2017, doi:10.5858/arpa.2017-0138-SA. [Epub ahead of print]
12. Smith M, Dalurzo M, Panse P, Parish J, Leslie K. Usual interstitial pneumonia-pattern fibrosis in surgical lung biopsies. Clinical, radiological and histopathological clues to aetiology. J Clin Pathol 2013; 66: 896-903.
13. Meyer KC, Raghu G, Baughman RP, et al. An Official American Thoracic Society Clinical Practice Guideline: The Clinical Utility of Bronchoalveolar Lavage Cellular Analysis in Interstitial Lung Disease. Am J Respir Crit Care Med 2012; 185: 1004-14.
14. Morell F, Roger A, Reyes L, Cruz MJ, Murio C, Muñoz X. Bird fancier´s lung: a series of 86 patients. Medicine (Baltimore) 2008; 87: 110-30.
