MATÍAS BALDINI 1, MARÍA N. CHIAPELLA 1, ALEJANDRA FERNANDEZ 1, SERGIO GUARDIA 1, EDUARDO L. DE VITO 2, HERNANDO SALA 1
1 Laboratorio de Función Pulmonar y Sueño, Hospital Nacional Profesor Dr. Alejandro Posadas, El Palomar, Buenos Aires, 2 Departamento de Neumonología, Instituto de Investigaciones Médicas Alfredo Lanari, Universidad de Buenos Aires, Argentina; Centro del Parque, Cuidados Respiratorios, Buenos Aires, Argentina
Resumen La capacidad de difusión de monóxido de carbono (DLCO) es, después de la espirometría, la prueba de función pulmonar rutinaria y no invasiva de mayor utilidad clínica. No obstante, hay sustanciales errores de interpretación del significado fisiológico de la DLCO, de sus medidas derivadas y por consiguiente del significado clínico de sus alteraciones. Además de la utilización de diferentes nomenclaturas, otras fuentes de confusión han contribuido a cierta visión negativa de la prueba. Los aspectos técnicos de la prueba de DLCO tienen la ventaja de estar estandarizados. Pero a diferencia de lo que ocurre con otras pruebas de función pulmonar donde disponemos de valores de referencia que permiten determinar la “normalidad o anormalidad” de las mismas, es difícil aplicar esta vía de análisis en el caso de la DLCO. El hecho central en el análisis de la DLCO, el factor de transferencia para el CO (KCO), y el volumen alveolar (VA) es que para una correcta interpretación es necesario tener en cuenta el mecanismo por el cual la patología induce el cambio. Un KCO del 100% puede ser considerado normal en unas circunstancias o patológico bajo otras y, por el momento, el informe automatizado del estudio no puede discriminar. Este artículo describirá los principios de la prueba de DLCO, presentará diferentes modelos de análisis, expondrá ejemplos concretos y ofrecerá pautas para su correcta interpretación. Se considera indispensable efectuar un análisis integrado de la prueba de DLCO en relación con otras pruebas funcionales y con los datos clínicos.
Palabras clave: monóxido de carbono, difusión, intercambio gaseoso, función pulmonar
Abstract The diffusing capacity for carbon monoxide (DLCO) is, after spirometry the standard and noninvasive pulmonary function test of greater clinical use. However, there are substantial errors in the interpretation of the physiological significance of the DLCO, its derived measures and, therefore the clinical significance of its alterations. In addition to the use of different nomenclatures, other sources of confusion have contributed to some negative view of the test. The technical aspects of the DLCO test have the advantage of being well standardized. But unlike what happens with other pulmonary function tests where we have reference values which allow us to determine their “normality or abnormality”, it is difficult to apply this route of analysis in the case of DLCO. The central fact in the analysis of DLCO, transference factor for CO (KCO), and alveolar volume (VA) is that for a correct interpretation it is necessary to think about the mechanism by which the pathology induces change. A KCO of 100% can be considered normal in some circumstances or pathological in others and, for the moment, the automated study report cannot discriminate. This article will address the principles of the DLCO test; present different models of analysis submit concrete examples and provide guidelines for their correct interpretation. It is considered essential to carry out an integrated analysis of the DLCO test in relation to other functional tests and clinical data.
Key words: carbon monoxide, diffusion, pulmonary gas exchange, lung function tests
Dirección postal: Dr. Matías Baldini, Maison 769, 1714 Castelar, Buenos Aires, Argentina
e-mail: mbaldini@intramed.net
Conocimiento actual
• La determinación de la DLCO es una de las pruebas de función pulmonar rutinaria y no invasiva de mayor utilidad clínica.
• No obstante, hay sustanciales errores de interpretación de la DLCO y de sus medidas derivadas. Esto ha contribuido a cierta visión negativa de la prueba.
Contribución del artículo al conocimiento actual
• El hecho central es que la DLCO no puede ser analizada aisladamente, sin considerar KCO y VA. De lo contrario, se puede perder información clínica relevante.
• Es necesario tener en cuenta el mecanismo por el cual la afección induce el cambio.
• Es recomendable el análisis integrado de la prueba en relación con otras pruebas y con los datos clínicos.
Han pasado más de 100 años desde que Marie Krogh, desarrolló el método para medir el pasaje del monóxido de carbono (CO) por respiración única en el pulmón 1. Su experimento fue diseñado originalmente para resolver una controversia de la época: A principios del siglo XX había dos escuelas de pensamiento entre los fisiólogos respiratorios. Bohr y Haldane en Reino Unido creían que el pasaje de oxígeno podía ocurrir solo por un proceso activo de secreción desde el alvéolo hacia la sangre, mientras que los esposos August y Marie Krogh en Dinamarca, argumentaban que dicho proceso se daba a través de una difusión pasiva entre el aire y la sangre.
La doctora Marie Krogh en su laboratorio de zoofisiología de la Universidad de Copenhague, desarrolló un método para determinar la difusión del oxígeno (O2) a través de los pulmones del hombre durante el reposo y durante el trabajo muscular. Describió una constante, que denominó constante de difusión para O2, como el número de centímetros cúbicos de O2 que difundirá desde los alvéolos a la sangre en un minuto a una diferencia de presión de 1 mmHg. Sus conclusiones fueron categóricas:
1. La difusión es independiente del volumen pulmonar hasta un cierto volumen, que parece corresponder a la capacidad pulmonar media (definida por Christian Bohr como el volumen residual (RV) + volumen de reserva espiratorio (ERV) + el 50% del volumen corriente (Vt)). Cuando el volumen aumenta, la difusión aumenta en proporción al volumen.
2. La difusión aumenta durante el trabajo muscular independientemente de cualquier cambio en la capacidad pulmonar media y el aumento se debe a cambios en la velocidad circulatoria.
3. La difusión es suficiente para explicar el intercambio de gases entre el aire alveolar y la sangre, tanto a baja presión parcial de O2 como durante el trabajo muscular más intenso.
La cuestión fue resuelta a favor de la difusión pasiva.
De hecho, hasta donde conocemos, la difusión es el único proceso físico involucrado en el movimiento de gases respiratorios, O2 y dióxido de carbono (CO2), entre el ambiente exterior, el aire o el agua, y los fluidos internos, ya sea de animales como de plantas.
La influencia del trabajo de Marie Krogh llegó hasta nuestros días. Además de echar por tierra la creencia popular de que el epitelio alveolar funcionaba como una glándula, secretando O2 de forma activa en la sangre capilar, con algunas modificaciones, hoy los laboratorios hablan de la difusión pulmonar del CO (DLCO) y del factor de transferencia de CO en el pulmón (TLCO) 2.
Si bien el método se transformó en la base de la prueba utilizada actualmente, EEUU y Europa adoptaron nomenclaturas diferentes. Este ha sido uno de los factores de confusión. La Tabla 1 compara esas diferencias de nomenclatura, sus unidades y sus equivalencias.
La DLCO es, después de la espirometría y la determinación de los volúmenes pulmonares, la prueba de función pulmonar rutinaria y no invasiva de mayor utilidad clínica y proporciona una imagen integrada de los complejos mecanismos involucrados en la transferencia de oxígeno del aire atmosférico a los capilares pulmonares.
No obstante, hay sustanciales errores de interpretación del significado fisiológico de la DLCO, de sus medidas derivadas y por consiguiente del significado clínico de sus alteraciones. Además de la utilización de diferentes nomenclaturas, otras fuentes de confusión han contribuido a cierta visión negativa de las pruebas de difusión de CO (Tabla 2).


Este artículo analiza los principios de la prueba de DLCO, expone ejemplos concretos para ilustrar estas dificultades y ofrece pautas para su interpretación. Un conocimiento acabado de los principios fisiológicos es la manera de comprender la importancia clínica de la DLCO, el volumen alveolar (VA) y el factor de transferencia del CO (KCO). Para maximizar la información clínica derivada de esas mediciones, se debe analizar también la relación entre la capacidad pulmonar total (TLC) y el volumen alveolar accesible (relación TLC / VA). Si no se consideran estas variables, se puede perder información clínica relevante. Así mismo, se considera indispensable efectuar un análisis integrado de la prueba de DLCO en relación con otras pruebas funcionales y con los datos clínicos.
Aspectos fisiológicos
El propósito de medir DLCO es obtener información sobre el área alvéolo-capilar efectiva disponible para la transferencia de gas en el pulmón. Con el fin de realizar un correcto intercambio gaseoso se requiere, una adecuada ventilación alveolar, una correcta difusión de gases entre los alvéolos y los capilares, un adecuado aporte sanguíneo pulmonar y una apropiada concentración de hematíes y hemoglobina (Hb)3. La ley de difusión de Fick describe el flujo de gas a través de una barrera 4.

La fórmula pone en evidencia que la cantidad de gas transferido (V) es directamente proporcional al área (A), a la constante de difusión (K) y al gradiente de presión parcial a través de la membrana (P1 – P2) y es inversamente proporcional al grosor de la membrana (T).
Pero debido a que no es posible determinar el área del tejido (A), el espesor (T) y la constante de difusión (K) de la membrana alvéolo capilar para todo el pulmón, estas variables se reemplazan por una constante única, DL, que representa la capacidad de difusión del pulmón 4.

¿Por qué se mide la capacidad de difusión del CO y no la del O2?
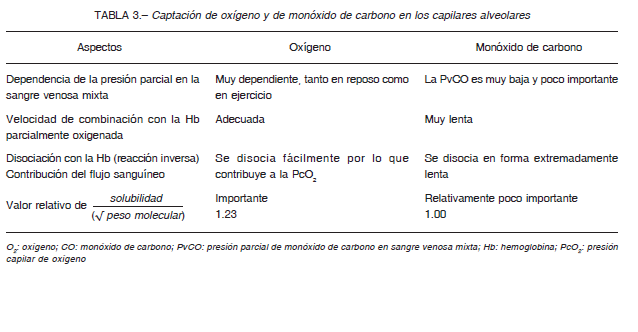
Si bien la molécula más relevante para el metabolismo celular es el O2, por diversas razones, se mide la transferencia de CO (Tabla 3):
1) Tanto el CO como el O2 difunden fácilmente a través de la membrana alvéolo-capilar y se combinan con la Hb, pero el CO tiene una afinidad de unión a la Hb unas 210 veces mayor que la del O2.
2) Debido a esto, una concentración de CO inspirada suficientemente baja prácticamente no produce aumento de la presión parcial del CO (PCO) en el capilar pulmonar y, de hecho, no causa una saturación completa de la Hb.
3) Por lo tanto, la captación de CO en el capilar pulmonar no se ve afectada por la rapidez con que la sangre pasa a través de los capilares y está “limitada por la difusión”.
4) Por el contrario, la presión parcial del O2 (PO2) en el capilar aumenta a medida que los glóbulos rojos atraviesan el capilar pulmonar, por lo que, en condiciones normales de gasto cardíaco en reposo, la PO2 alveolar y capilar entran casi en equilibrio cuando el glóbulo rojo solo estuvo un tercio del tiempo total de contacto con el capilar. En este punto, no se puede transferir más O2.
5) Sin embargo, si fluye más sangre a través del capilar, se puede absorber una mayor cantidad de O2, haciendo que la absorción de O2 esté “limitada por la difusión y perfusión”.
6) De manera que la difusión del O2 depende del factor membrana y factor flujo, mientras que la del CO depende solo de la membrana. Por tal motivo, se mide la difusión del CO.
¿Qué relación hay entre la hipoxemia que se observa en la práctica clínica y la medida de la DLCO?
Es comprensible invocar alteraciones en la difusión en pacientes que tienen fibrosis pulmonar idiopática, congestión o edema de pulmón o enfisema para justificar la hipoxemia en reposo. Pero la misma suele ser debida a la irregularidad de la relación ventilación/perfusión (V/Q).
Es cierto que la DLCO está disminuida, pero en reposo no parece ser la causa de hipoxemia.
Es conveniente, en lugar de centrar la atención en una membrana engrosada o una superficie de intercambio disminuida, considerar que la alteración de la estructura pulmonar produce también dispersión de las constantes de tiempo de llenado y vaciado de los alvéolos, esto lleva a irregularidad en la distribución de la ventilación y por consiguiente de la relación V/Q e hipoxemia 5.
En el pulmón normal en reposo hay grandes reservas de difusión (en reposo, el equilibrio con el capilar se produce antes de la mitad del tiempo total de contacto), estas reservas se demuestran en el ejercicio, que pone a prueba la capacidad de difusión pulmonar al reducir el tiempo empleado por la sangre en el capilar pulmonar 5.
La capacidad de difusión aumenta con el ejercicio, pero la hipoxemia de pacientes con desigualdad de relación V/Q puede mejorar o empeorar dependiendo de la respuesta ventilatoria, cardíaca y del patrón de desigualdad de V/Q.
La técnica de dilución de gases inertes muestra que, aunque hay algunas situaciones en las que la transferencia de O2 puede estar limitada por la difusión, la falta de coincidencia entre ventilación y perfusión y el shunt son las causas mucho más importantes de hipoxemia, aún en las enfermedades en las que está engrosada la membrana alvéolo-capilar 6, 7.
Componente membrana y componente flujo sanguíneo
Si bien la elección del CO, por sus características (Tabla 3), permite evaluar la membrana alvéolo-capilar, resulta de interés destacar el papel del flujo sanguíneo pulmonar en el proceso de difusión. El último paso en el proceso de difusión del O2 y en este caso el del CO es su unión a la Hb; una disminución de la concentración de la Hb o del flujo sanguíneo también disminuye la DLCO, mientras que un aumento en el flujo sanguíneo pulmonar (como el que ocurre en el ejercicio), la aumenta.
Si se consideran a las diferentes barreras que el CO debe atravesar para llegar desde el alvéolo hasta la sangre, como resistencias en series, es posible plantear la siguiente igualdad conocida como ecuación de Roughton-Forster 8:
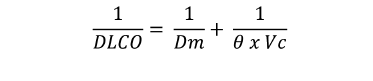
Donde 1/DLCO es la resistencia total del sistema que surge de la suma de 2 componentes o resistencias:
1) la resistencia de la membrana alvéolo-capilar, (1/Dm) y
2) la resistencia de la sangre también conocida como resistencia reactiva, (1/ θ x Vc)
Donde Vc es el volumen capilar pulmonar y θ una constante que representa la capacidad de ganancia de CO por cada unidad de volumen de sangre. Obviamente, como difusión solo puede ser considerado el primero de los términos de la suma ya que el segundo (componente flujo sanguíneo) afecta la transferencia del CO pero no puede ser considerado como difusión entendida como pasaje de un gas a través de una membrana. Debido a este concepto es que los europeos prefieren denominar al método como TLCO y no DLCO (Tabla 1). Es necesario destacar que el 75 % de la resistencia del sistema reside en el segundo componente denominado componente reactivo. Desafortunadamente, la división de la DLCO en sus componentes de “membrana” y “flujo sanguíneo” no ha tenido hasta el momento un impacto en la toma de decisiones clínicas.
Metodología para la medición de la DLCO. De Krogh a nuestros días
La determinación de la DLCO mediante respiración única tiene la ventaja de estar bien estandarizada y es ampliamente utilizada en la mayoría de los estudios clínicos 9. Se dispone de varias ecuaciones de referencia para DLCO de respiración única 10- 17.
En 1915 Marie Krogh introdujo la medida de la “constante de difusión pulmonar para el CO como el producto de dos medidas separadas, las cuales pueden potencialmente variar ampliamente (e independientemente)…”.
Ella se refirió a:
1) el “factor de permeabilidad” al que ella llamó KCO y 2) el volumen alveolar (VA) presente en ese momento.
Estas dos variables conforman las mediciones primarias de la prueba de DLCO por respiración única. Este concepto es fundamental para una correcta interpretación de la prueba.
En realidad, Marie Krogh puntualizó que TLCO es el producto de las constantes de tiempo de desaparición del CO y el VA. Llamó factor de permeabilidad (KCO) a la constante de tiempo1. En nuestros días, el factor de permeabilidad de Krogh fue sustituido por TLCO/VA (o DLCO/VA). Hoy acordamos que KCO o DLCO/VA (o TLCO/VA) implica que el índice es integral para el intercambio de gases (y una medición primaria). Implica que es parte de la medición de DLCO (o TLCO) por respiración única. Otro elemento de confusión fue que desde la publicación de su trabajo en 1915, se asumió que TLCO/VA era un factor constante. Sin embargo, la relación entre superficie y volumen no es constante: aumenta con la disminución del VA y disminuye con el aumento del VA (ver luego).
En la Figura 1 se esquematiza la maniobra de difusión.
El equipo tiene una fuente de gas de prueba, un dispositivo para medir volúmenes inspirados y espirados, y analizadores de gas para CO y el gas inerte (0,3% de metano, 0,3% de neón o 10% de helio) 4.
Se debe instruir a los sujetos para que se abstengan de hacer ejercicio vigoroso o fumar el día de la prueba.
Para su realización, se utiliza una mezcla gaseosa de aire ambiente, 0,3% de CO y un gas inerte. Las pautas generales son las siguientes:
1) Se coloca un clips nasal y se instruye al sujeto para que respire a volumen corriente normal de reposo.
2) Una vez que se alcanza un patrón respiratorio estable, se instruye al sujeto para que exhale completamente, con el objeto de alcanzar el RV.
3) Se abre la válvula del gas de prueba, y se le indica al sujeto que tome una inhalación completa y rápida hasta llenar sus pulmones. Se espera un volumen inhalado de al menos el 85% de la capacidad vital (VC) sobre la base de la espirometría (inspirando en 4 segundos). En caso de tener la TLC, la relación VA/TLC no debe ser inferior al 80%.
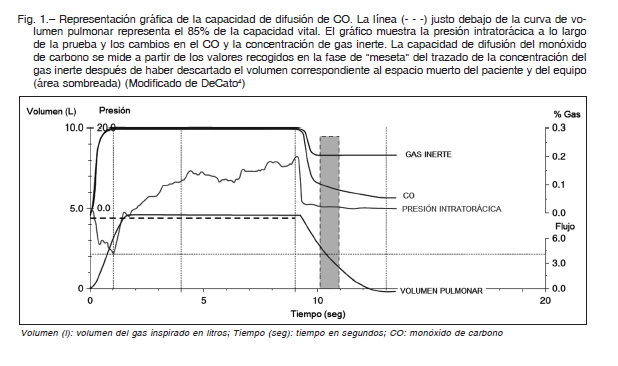
4) El sujeto realiza una apnea en inspiración de unos 9-11 segundos. Durante la apnea no debe haber evidencia de fugas de aire, evitando las maniobras de Valsalva o Müller ya que pueden disminuir o aumentar el volumen de sangre capilar respectivamente. La presión intrapulmonar debe estar cerca de la atmosférica, esto último se logra haciendo que el sujeto mantenga voluntariamente la inspiración completa usando solo el mínimo esfuerzo necesario. Algunos equipos son capaces de monitorear la presión bucal.
5) Luego de la apnea, se procede a la exhalación en unos 4 segundos. Se desecha un volumen de lavado de 0,75-1 litros (que contiene espacio muerto para el paciente y el instrumento).
6) Luego se colecta un volumen 0,5-1 litro, que debe asegurarse corresponda a la fase de meseta del gas inerte (estos volúmenes son ajustado si la VC es menor de 2 litros) 4, 9.
El primer paso en la interpretación del KCO en presencia de un VA bajo es verificar si el VA ha subestimado significativamente la VC o la TLC (ver ítem 3). Antes de hacer inferencias mecanicistas en un KCO alto debido a un VA bajo, es crucial descartar la inspiración submáxima como la causa de un VA bajo.
La necesidad de un gas inerte
Es evidente que la concentración de CO del gas inhalado sufrirá una dilución cuando se ponga en contacto con el gas del RV pulmonar del paciente. Así, la concentración de CO en el alvéolo será menor que la del gas inspirado y será menor al ser exhalado, aún si nada de CO hubiera pasado a la circulación. Debido a esto, es necesario agregar a la mezcla de gas inspirado otro gas que se diluya igual que el CO pero que no pase a la sangre, es decir un gas inerte, de modo que el análisis del gas espirado permita determinar el grado de dilución del gas inerte e inferir a partir de la misma cuanto se ha diluido el CO y por lo tanto cuál era su concentración inicial en el gas alveolar que estará disponible para difundir justo antes de comenzar
la apnea de 10 segundos. Es evidente que el grado de dilución del gas inerte se conocerá una vez iniciada la fase espiratoria de la maniobra.
Cómo se calculan KCO, VA y DLCO
KCO es simplemente la diferencia entre la concentración inicial de CO (CO I), estimada a partir de la dilución del gas inerte, y la final (CO F), medida directamente de la muestra del gas espirado, esa diferencia es lo que se ha transferido a la sangre durante el tiempo de apnea (Fig. 1), y se expresa como:

Es entonces el KCO, la primera variable calculada por el método y representa el promedio de todos los KCO de los alvéolos individuales que están ventilados y perfundidos.
El VA, segunda variable calculada por el método, representa una estimación del volumen de gas pulmonar en el que el CO se distribuye y diluye, y desde donde luego se transfiere a través de la membrana alvéolo-capilar.
Este dato es crítico en la medición de DLCO.
Como se conoce la dilución que ha sufrido el gas inerte, es posible estimar el volumen total del gas alveolar. Es importante destacar que el volumen de gas calculado es aproximado y no es de extrañar que no sea el mismo que el obtenido con las mediciones de TLC y RV por método de dilución. Al ser una respiración única es improbable que el gas inspirado se diluya en todo el volumen pulmonar residual ya que los sectores del pulmón que tienen relación V/Q muy baja, es decir están mal ventilados, difícilmente equilibren su mezcla gaseosa con el gas inspirado.
Entonces el VA se calcula de la siguiente manera:
VA = (VI – VD) × ((FI,Tr)⁄(FA,Tr))
VA es igual al volumen inspirado (VI) (que mide directamente el equipo, menos el espacio muerto (VD), se puede calcular, multiplicado por la relación entre la fracción inspirada del gas trazador (FI, Tr), (conocida) y la fracción alveolar del gas trazador (FA, Tr), (medida por el equipo en la espiración).
Finalmente, una vez obtenidas las dos variables principales, DLCO se calcula de la siguiente manera:
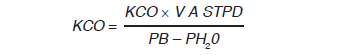
O lo que es lo mismo, más sencillo y con implicancias importantes en la interpretación clínica:
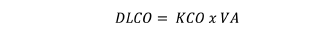
Desde la descripción inicial de la prueba hacia finales de la década de los 80 se analizaban ambos componentes del mismo, KCO y VA. En el inicio de la década de 1990 se relativizó el análisis del KCO poniéndose énfasis solo en la DLCO. Posteriormente, Hughes y Pride, en 2001 revalorizaron el análisis del KCO 18. Respecto a esta controversia, conviene destacar que lo que se mide inicialmente son el KCO y el VA y se calcula la DLCO a partir del producto de estas dos variables, por lo tanto no parece adecuado analizar el comportamiento solo de la DLCO.
Es evidente que DLCO puede variar como resultado de diversas combinaciones de valores de KCO y VA.
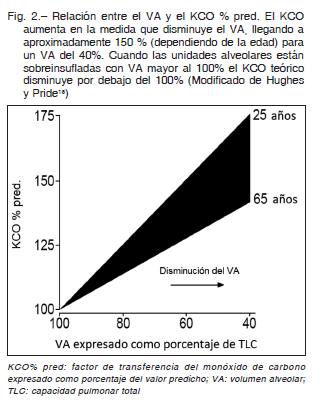
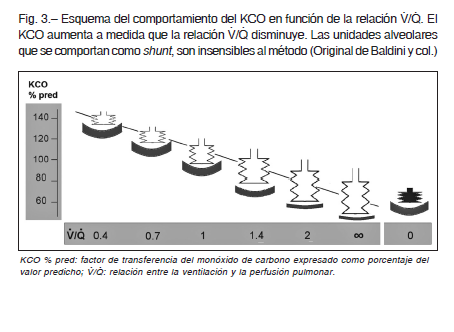
Coronando una serie de estudios publicados desde 1959 por otros autores, Stam y col. 19, 20 describieron el comportamiento del KCO y de la DLCO medidos a distintos volúmenes inspiratorios por debajo de la TLC (reducción voluntaria del VA) y demostraron que a medida que se produce un descenso del VA, el KCO aumenta en forma lineal pero no proporcional (Fig. 2). Esto se explica porque el KCO es una medida de eficiencia, es decir, mide cuán eficientes son las unidades alveolares para realizar la transferencia del CO. Por lo tanto, a medida que el VA disminuye las unidades alveolares se tornan más eficientes. Este efecto se debería a que los alvéolos podrían comportarse como un acordeón cuya superficie tiende a plegarse y son preservadas mejor que el volumen; además la perfusión también tiende a preservarse ya que el volumen capilar si bien también disminuye, lo hace en menor proporción. Por lo tanto habría más superficie de membrana disponible para una menor cantidad de gas, por lo que el intercambio gaseoso se produciría con mayor facilidad (más eficientemente). Expresado esto en términos de relación V/Q, correspondería a unidades alveolares con una relación V/Q baja. Es importante destacar que si el VA aumenta, por ejemplo en un pulmón vicariante, el KCO disminuye por las razones exactamente opuestas a las antes analizadas. Aquellas unidades alveolares perfundidas pero no ventiladas (shunt), son insensibles al método (Fig. 3).
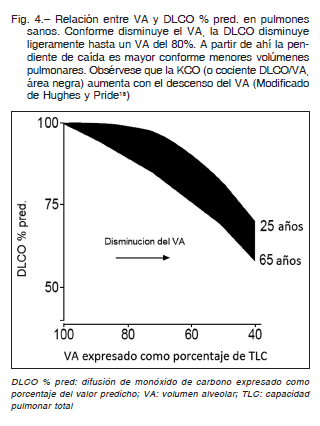
Esto no significa que una disminución del VA mejora la difusión sino todo lo contrario. Stam 19, 20 también demostró que a medida que el VA disminuía, también lo hacía la DLCO (Fig. 4). Esto se explica porque, como se dijo anteriormente, DLCO es igual al producto de KCO por el VA y, si bien la disminución del VA aumenta la eficiencia de las unidades alveolares, es decir aumenta el KCO, siempre este aumento es, proporcionalmente, menor que la disminución del VA, por lo tanto el producto final de esta multiplicación es una caída de la DLCO. Es posible concluir entonces que, en personas sin trastornos parenquimatosos ni de la perfusión pulmonar, a medida que se reduce el VA, el KCO aumenta y la DLCO disminuye.
Influencia de la circulación pulmonar y de la hemoglobina
La influencia de la circulación pulmonar en el proceso de difusión durante el ejercicio fue estudiada por Hsia y col. 21.
Ellos demostraron que con el ejercicio, a VA constante, DLCO y KCO aumentan. La razón es que el aumento de la presión arterial pulmonar y, en menor medida, de la presión venosa, que acompaña al aumento del flujo sanguíneo, distiende el lecho capilar pulmonar y recluta vasos septales alveolares adicionales. La duplicación del volumen minuto implica un incremento de aproximadamente entre el 15% y 20% en el KCO.
También la concentración de Hb modifica el KCO. Por cada unidad porcentual de caída en la concentración de Hb, el KCO cae aproximadamente un 4% 22. Este es el motivo por el cual el cálculo de la DLCO debe corregirse por la Hb real del paciente.
Interpretación
A diferencia de lo que ocurre con la mayoría de las pruebas de función pulmonar más utilizadas, donde disponemos de valores de referencias que nos permiten determinar la “normalidad o anormalidad” de la misma, es difícil aplicar ese concepto de análisis o interpretación en la prueba de difusión. Se podría entonces, simplemente informar si la DLCO es normal o se encuentra disminuida y en qué grado de severidad, de acuerdo a las ecuaciones de referencia que se seleccionen, que a su vez podrían ser más rigurosas si se dispusiera de intervalos de confianza de 95 % expresados como Z score 17, 23. Pero el hecho central en el análisis del KCO y la DLCO es que para una correcta interpretación es necesario tener en mente el mecanismo por el cual la patología induce el cambio.
Recientemente Neder y col. 24 han publicado una revisión en donde enfatizan la importancia del contexto clínico para maximizar la información derivada de la prueba de difusión. De manera que un KCO del 100% puede ser considerado como normal en unas circunstancias o patológicamente bajo en otras, un hecho que, por el momento, el informe automatizado del estudio no puede discriminar. Es necesario entonces considerar diferentes modelos de análisis.
Como se discutió anteriormente, Stam y col. 19 sugirieron que cuando la TLC se reduce por enfermedad, los valores de DLCO deberían compararse con los valores de referencia basados en el VA observado, pero advirtieron que esto supone que “el efecto de la disminución del volumen pulmonar por enfermedad tiene el mismo efecto en el KCO que el producido por la reducción voluntaria en el volumen pulmonar en voluntarios sanos”. Por ello, se expondrán los diferentes mecanismos de reducción en VA para enfatizar las debilidades de esta suposición y generar modelos de análisis para una correcta interpretación de la DLCO. Consideramos indispensable, la interpretación de los resultados de la DLCO en conjunto con la espirometría y los volúmenes pulmonares.
Modelos de análisis
Espirometría y volúmenes pulmonares con patrón restrictivo
Modelo de pérdida localizada de unidades alveolares
El ejemplo más representativo de esta situación lo constituye la resección pulmonar (neumonectomía) con pulmón remanente no enfermo (Fig. 5). Se puede esperar por un lado, un ligero aumento del volumen de las unidades alveolares remanentes (por efecto vicariante), y una ligera caída del KCO teórico por debajo del 100% (fue puntualizado que a medida que el VA aumenta, el KCO disminuye). Por otro lado, el pulmón remanente recibirá toda la volemia y, con unidades alveolares sobreperfundidas, el KCO debe situarse en el orden del 115 % a 120%. El resultado final de estas dos situaciones contradictorias es que en un paciente neumonectomizado el pulmón no enfermo remanente deberá tener un KCO de aproximadamente 110% como media de la normalidad.
Si DLCO = KCO x VA, la DLCO en esta circunstancia estará disminuida ya que el ligero incremento del KCO (10%) no logra compensar la caída del VA (50%). Por lo tanto bajo estas circunstancias, un KCO informado del 100% se debería interpretar como un pulmón remanente anormal, poniendo de manifiesto algún trastorno del intercambio gaseoso. Es importante entender que a estos pacientes no se le debe exigir un KCO de 140% como el que surgiría de la aplicación de la relación entre VA y KCO establecida por Stam y col 19, 20, sino aplicar el modelo descrito por Hsia y col 21.
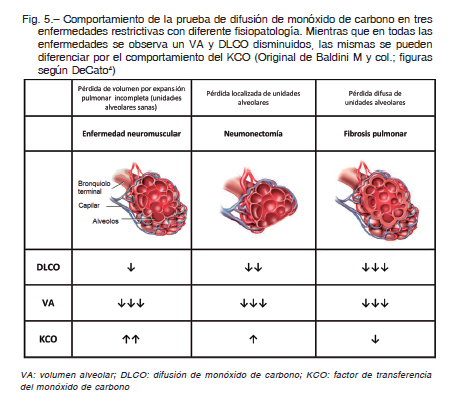
Modelo de pérdida de volumen por expansión incompleta
El mejor ejemplo de éste modelo lo constituyen las enfermedades neuromusculares con incompleta expansión pulmonar (Fig. 5). En esas circunstancias, la inmensa mayoría de los alvéolos no pueden alcanzar su volumen de TLC. Cabe esperar entonces que el KCO se comporte como en sujetos normales cuando hacen maniobras de difusión con un llenado pulmonar incompleto. En otras palabras, si estos pacientes tienen un volumen alveolar del 50%, el KCO que se debe asumir como referencia deberá ser el de los sujetos normales al 50% de VA, es decir alrededor del 140% dependiendo de la edad, en este caso, se aplica plenamente la relación establecida por Stam 20, 21. La DLCO, en esta circunstancia, estará disminuida pero menos que en el modelo anterior, ya que a una disminución similar del valor del VA, se lo multiplicará por un KCO superior. Nuevamente, un KCO del 100% en este contexto, deberá ser interpretado como anormal.
Contrariamente, valores de KCO y de DLCO acordes a los esperados para el VA en que fueron medido, podrían apoyar la presencia de una patología restrictiva debido a la debilidad de los músculos respiratorios y/o a deformidad de la caja torácica y sin alteración del intercambio gaseoso.
Modelo de pérdida difusa de unidades alveolares
Este es el caso de las enfermedades difusas del parénquima pulmonar como las neumonías intersticiales, enfermedades del tejido conectivo y neumoconiosis (Fig. 5). En los dos modelos anteriores, la estructura y la expansión del pulmón permanecen uniformes, mientras que en las intersticiopatías los cambios estructurales y funcionales son característicamente no uniformes. En estos pacientes pueden coexistir unidades alveolares enfermas, indemnes, con fibrosis intersticial y con menor flujo de sangre que, finalmente, se traducirán en una disminución del VA, del KCO y de la DLCO. Por lo tanto en estas condiciones un KCO del 100%, sí será expresión de un buen intercambio gaseoso; mientras que, conforme progresa el compromiso intersticial, se observará un descenso progresivo del VA, del KCO e indefectiblemente como producto de estos dos, de la DLCO. Y será bajo estas últimas circunstancias que se debe analizar el comportamiento del KCO y de la DLCO de acuerdo al VA al cuales fueron medidos siguiendo las relaciones establecidas por Stam para no sobrevalorar la caída de la DLCO ni subestimar el aumento del KCO 19.
Estos 3 modelos de análisis clínico se corresponden con patologías restrictivas que se manifiestan con disminución de la DLCO y del VA y se diferencian entre sí, por el comportamiento del KCO (Fig. 5).
Espirometría con patrón obstructivo
Se puede analizar también el comportamiento de la prueba en la patología obstructiva y dentro de este grupo a la EPOC. Un modelo especial es el del enfisema en el que existen circunstancias anatomopatológicas determinantes, como la disminución de la superficie de membrana con una relación membrana/volumen alveolar muy baja y déficit de perfusión por amputación del lecho vascular (Fig. 6). La resultante de todo esto es un KCO y DLCO disminuidos y un VA que tiende a estar conservado. En aquellos pacientes con EPOC que se comportan como bronquíticos crónicos y sin enfisema, bien podemos hallar un VA, KCO y DLCO normales (recuérdese que la tan conspicua hiperinflación en la EPOC se determina con técnica de dilución o con pletismografía). Entre estos dos extremos el grado de caída del KCO correlaciona muy bien con la severidad del enfisema o enfermedad bullosa.
Cabe resaltar al asma como un modelo complejo donde la difusión puede incrementarse, permanecer estable o disminuir, sin que se reconozcan exactamente los mecanismos implicados. Es de destacar, sin embargo, que el asma es una de las pocas situaciones en la que se puede encontrar una DLCO aumentada, principalmente en su etapa aguda. Unos de los mecanismos propuestos es un incremento en el flujo sanguíneo de los campos pulmonares superiores, con lo que disminuiría el área normalmente existente en vértices bien ventilada pero poco perfundida, así como por un aumento del volumen capilar secundario a la elevación de la presión intratorácica negativa 25.
Espirometría normal
No infrecuentemente se halla un patrón espirométrico normal con DLCO baja. Esta es una situación clínica en la cual la prueba de DLCO puede ser útil. En la enfermedad vascular pulmonar, es posible hallar un descenso de la DLCO y el KCO con un VA conservado y una espirometría normal (Fig. 6). El mecanismo por el que se produce el descenso de la DLCO y KCO en estas enfermedades es una disminución del volumen de sangre capilar por pérdida de lecho capilar, situación observada en la hipertensión arterial pulmonar ya sea primaria o secundaria a otras enfermedades como vasculitis, asociadas e enfermedades del colágeno y enfermedad tromboembolica 26.
No es posible soslayar que un patrón similar puede ser hallado tanto en la enfermedad pulmonar intersticial incipiente como en los pacientes con un trastorno combinado enfisema / fibrosis pulmonar.
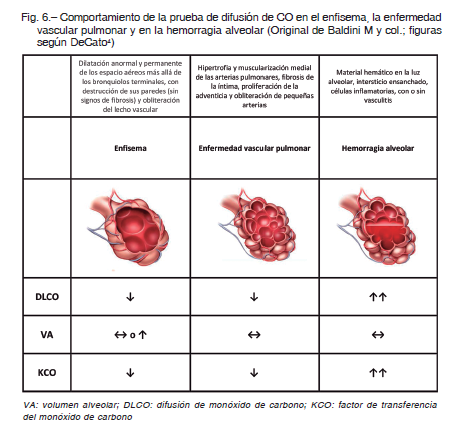
Hemorragia alveolar
El hallazgo de una DLCO aumentada en el contexto de una hemorragia alveolar es de gran utilidad diagnóstica 27, 28. La causa del aumento de la DLCO en estas circunstancias se debe a que, paradójicamente, el CO no tiene que difundir a través de la membrana, ya que al llegar al alvéolo encuentra en él a un gran número de hematíes a los que se une rápidamente, con lo que la concentración alveolar de CO desciende notablemente, como ocurriría si gran cantidad del mismo hubiese atravesado la membrana alvéolo-capilar, aunque en realidad no se ha producido difusión o transferencia de dicho gas (Fig. 6). Entonces, cuando se observa un KCO superior al 140% con un VA más o menos conservado y como consecuencia también una DLCO francamente aumentada, en el contexto clínico adecuado, la sospecha de una hemorragia alveolar se vuelve casi un hecho. Es importante destacar que cuando se detiene el sangrado, luego de 24 h el incremento en la DLCO se reduce al 50%.
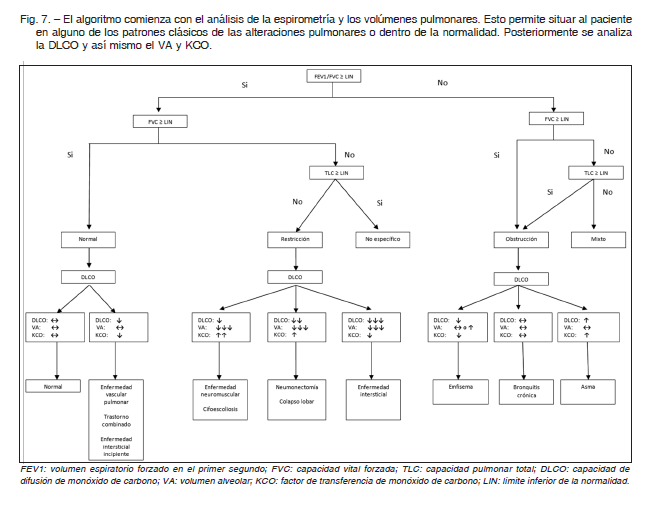
Es evidente que resulta altamente recomendable, por no decir inexcusable, efectuar un análisis integrado de la prueba de DLCO en relación con otras pruebas funcionales y los datos clínicos. La figura 7 propone un algoritmo simplificado donde la interpretación de la prueba de DLCO se realiza partiendo de los patrones espirométricos más frecuentemente utilizados, siguiendo por los volúmenes pulmonares y el análisis de la DLCO, VA y KCO.
Conclusiones
Una mejor comprensión de los principios fisiológicos es la mejor manera de comprender la importancia clínica de la DLCO, KCO y VA. Este artículo abordó los principios de la prueba de DLCO, presentó diferentes modelos de análisis, expuso ejemplos concretos y ofreció pautas para su correcta interpretación:
1) Si bien los aspectos técnicos de la prueba de DLCO están bien estandarizados, no es factible utilizar la misma vía de análisis para definir “normalidad” tal como es posible en la mayoría de las pruebas de función pulmonar.
2) Un KCO del 100% puede ser considerado normal en unas circunstancias o patológico bajo otras y, por el momento, el informe automatizado del estudio no puede discriminar.
3) El hecho central es que la DLCO no puede ser analizada aisladamente, sin considerar sus componentes que la determinan: VA y KCO. Si no se consideran estas variables, se puede perder información clínica relevante.
4) Para una correcta interpretación es necesario pensar el mecanismo por el cual la patología induce el cambio.
5) Se considera indispensable efectuar un análisis integrado de la prueba de DLCO en relación con otras pruebas funcionales y con los datos clínicos.
Conflicto de intereses: Ninguno por declarar
Bibliografía
1. Krogh M. The diffusion of gases through the lungs of man. J Physiol 1915; 49: 271-96.
2. Hughes JMB, Borland CDR. The centenary (2015) of the transfer factor for carbon monoxide (TLCO): Marie Krogh’s legacy. Thorax 2015; 70: 391-4.
3. Hughes J M, Bates D V. Historical review: the carbon monoxide diffusing capacity (DLCO) and its membrane (DM) and red cell (Theta.Vc) components. Respir Physiol Neurobiol 2003; 138: 115-42.
4. DeCato TW, Hegewald MJ. Breathing Red: Physiology of an Elevated Single-Breath Diffusing Capacity of Carbon Monoxide. Ann Am Thorac Soc 2016; 11: 2087-92.
5. West JB. Fisiología respiratoria. En: Difusión. Como atraviesan los gases la barrera hematogaseosa, 7° ed. Buenos Aires: Editorial Panamericana, 2005, p 25-34.
6. Wagner PD, Saltzman HA, West JB. Measurement of continuous distribution of ventilation-perfusion ratios: theory. J Appl Physiol 1974; 36: 588-99.
7. DeCato TW, Hegewald MJ. Breathing Red: Physiology of an elevated single-breath diffusing capacity of carbon monoxide. Ann Am Thorac Soc 2016; 13: 2087-92.
8. Roughton FJW, Forster RE. Relative importance of diffusion and chemical reaction in determining rate of exchange of gases in the human lung. J Appl Physiol 1957; 11: 290-302.
9. Graham BL, Brusasco V, Burgos F, et al. 2017 ERS/ATS standards for single-breath carbon monoxide uptake in the lung. Eur Respir J 2017; 49: 1600016.
10. Thompson B, Johns D, Bailey M, et al. Prediction equations for single breath diffusing capacity (TLCO) in a middle aged Caucasian population. Thorax 2008; 63: 889-93.
11. Koopman M, Zanen P, Kruitwagen C, et al. Reference values for paediatric pulmonary function testing: the Utrecht dataset. Respir Med 2011; 105: 15-23.
12. Garcia-Rio F, Dorgham A, Galera R, et al. Prediction equations for single-breath diffusing capacity in subjects aged 65 to 85 years. Chest 2012; 142: 175-84.
13. Kim YJ, Hall G, Christoph K, et al. Pulmonary diffusing capacity in healthy Caucasian children. Pediatr Pulmonol 2012; 47: 469-75.
14. Thomas A, Hanel B, Marott J, et al. The single-breath diffusing capacity of CO and NO in healthy children of European descent. PLoSOne 2014; 9: e113177.
15. Michailopoulos P, Kontakiotis T, Spyratos D, et al. Reference equations for static lung volumes and TLCO from a population sample in northern Greece. Respiration 2015; 89: 226-34.
16. Verbanck S, Van Muylem A, Schuermans D, et al. Transfer factor, lung volumes, resistance and ventilation distribution in healthy adults. Eur Respir J 2016; 47: 166-76.
17. Stanojevic S, Graham BL, Cooper BG, et al. Official ERS technical standards: Global Lung Function Initiative reference values for the carbon monoxide transfer factor for Caucasians. Eur Respir J 2017; 50: 1700010.
18. Hughes JMB, Pride NB. In defense of the carbon monoxide transfer coefficient KCO (TL/VA). Eur Respir J 2001; 17: 168-74.
19. Stam H, Hrachovina V, Stijnen T, Versprille A. Diffusing capacity dependent on lung volume and age in normal subjects. J Appl Physiol 1994; 76: 2356-63.
20. Stam H, Splinter TAW, Versprille A. Evaluation of pulmonary diffusing capacity in patients with a restrictive lung disease. Chest 2000; 117: 752-7.
21. Hsia CCW, McBrayer DG, Ramanathan M. Reference values of pulmonary diffusing capacity during exercise by a rebreathing technique. Am J Respir Crit Care Med 1995; 152: 658-65.
22. Cotes JE, Dabbs JM, Elwood PC, Hall AM, McDonald A, Saunders MJ. Iron-deficiency anaemia: its effect on transfer factor for the lung (diffusing capacity) and ventilation and cardiac frequency during sub-maximal exercise. Clin Sci 1972; 42: 325-35.
23. Quanjer PH, Pretto JJ, Brazzale DJ, Boros PW. Grading the severity of airways obstruction: New wine in new bottles. Eur Respir J 2014; 43: 505-12.
24. Neder JA, Berton DC, Muller PT, O’Donnell DE. Incorporating lung diffusing capacity for carbon monoxide in clinical decision making in chest medicine. Clin Chest Med 2019; 40: 285-305.
25. Collard P, Ninjou B, Nejadnik B, Keyeux A, Frans A. Single breath diffusing capacity for carbon monoxide in stable asthma. Chest 1994; 105: 1426-9.
26. Hughes JMB. The single breath transfer factor (Tl,co) and the transfer coefficient (Kco): a window onto the pulmonary microcirculation. Clin Physiol Funct Imaging 2003; 23: 63-71.
27. Ewan PW, Jones HA, Rhodes CG, Hughes JMB. Detection of intrapulmonary haemorrhage with carbon monoxide uptake. Application in Goodpasture syndrome. N Engl J Med 1976; 295: 1391-6.
28. Greening AP, Hughes JMB. Serial estimations of carbon monoxide diffusing capacity in intrapulmonary haemorrhage. Clin Sci 1981; 60: 507-12.
