CARINA SIMIONATO 1, CARLA MINAUDO 1, TOMÁS MOSQUERA 1, MARIO MARINI 2, ALBERTO SAPONARO 1, FÉLIX VIGOVICH 3
1 Servicio Dermatología, Hospital Británico de Buenos Aires, 2 Cátedra de Dermatología, Facultad de Medicina, Universidad de Buenos Aires, 3 Servicio de Anatomía Patológica, Hospital Británico de Buenos Aires, Argentina
Resumen El melanoma desmoplásico es una variedad infrecuente de melanoma que se distingue por su presentación clínico-patológica y su comportamiento biológico. El diagnóstico temprano es un desafío por su presentación clínica variable, con predominio del componente dérmico y la frecuente ausencia de pigmento. En la histología se lo divide en puro y mixto y esta clasificación tiene importantes implicancias pronósticas. El espesor de Breslow promedio al momento del diagnóstico es mayor que en otras variantes de melanoma, sin embargo, la tendencia a generar metástasis ganglionares es menor.
Palabras clave: melanoma desmoplásico, melanoma amelanótico, melanoma desmoplásico puro y mixto
Abstract Desmoplastic melanoma is a rare presentation of melanoma with a different clinical behavior compared to other histological variants. Its diagnosis in early stages is a challenge due to its variable clinical presentation, with a predominant dermal component and the frequent absence of pigment. Its histology is divided into pure and mixed type, and this classification has important prognostic implications. The average Breslow thickness at diagnosis is higher than in other melanoma variants. However, the tendency to lymph node metastasis is low.
Key words: desmoplastic melanoma, amelanotic melanoma, pure and mixed desmoplastic melanoma
Dirección postal: Carina Simionato, Servicio de Dermatología, Hospital Británico de Buenos Aires, Perdriel 74, 1280 Buenos Aires, Argentina
e-mail: cisimionato@hotmail.com
El melanoma desmoplásico (MD) es una variedad rara de melanoma. Representa menos del 4% de los melanomas cutáneos primarios, con una tasa global de incidencia de 2.0 por millón 1, 2.
Por lo general se lo encuentra en personas mayores, con exposición solar excesiva y crónica. Suele afectar más a hombres que a mujeres, en una relación 2:1, con una edad media de diagnóstico de 66 años 1, 2.
Algunos melanomas desmoplásicos muestran un fenotipo más puro que otros. Cuando la desmoplasia es prominente en todo el tumor, se lo denomina MD puro (MDp). En otros, constituye solo una parte de un melanoma invasivo, por lo demás no desmoplásico; de esta forma, los tumores combinados se describen como MD mixto (MDm) 3.
Describimos dos casos de melanoma desmoplásico mixto con componente extensivo superficial en dorso y uno de los casos con presentación clínica amelanótica.
Caso clínico 1
Mujer de 63 años, sin antecedentes clínicos de importancia. Consultó al Servicio de Dermatología por un tumor de 2 cm de diámetro, de 1 año de evolución, en región escapular derecha, indurado y asintomático; sin antecedentes de trauma o lesión inflamatoria en la zona del tumor.
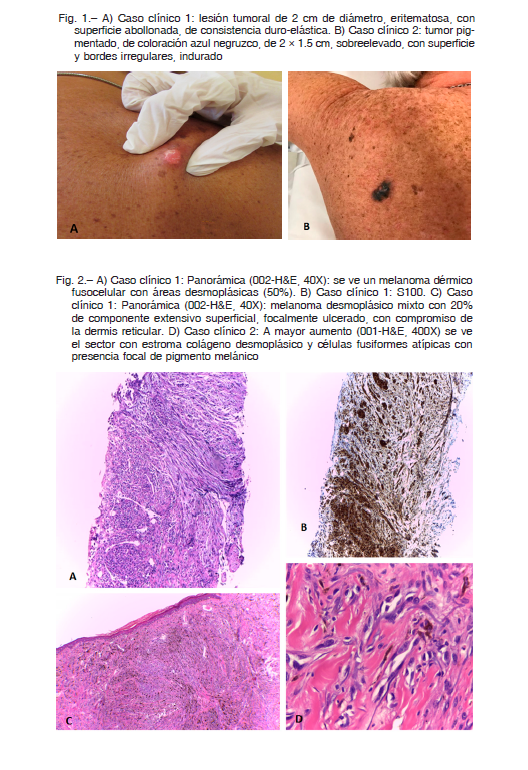
En región escapular derecha se observó, sobre un trasfondo de intenso fotodaño, una lesión tumoral de 2 cm de diámetro, eritematosa, con superficie abollonada, de consistencia duroelástica y no dolorosa a la palpación, que se extendía en profundidad (Fig. 1A).
Con diagnóstico clínico presuntivo de dermatofibrosarcoma protuberans se realiza una biopsia para arribar al diagnóstico de certeza y descartar diagnósticos diferenciales posibles como dermatofibroma, queloide espontáneo, melanoma desmoplásico o sarcoma.
En el estudio histopatológico se observó una neoplasia maligna fusocelular y epiteliode compatible con melanoma (Fig. 2A).
Se procede a la extirpación quirúrgica completa de la lesión, con un margen de seguridad de 3 cm.
El estudio del ganglio centinela de axila derecha fue negativo.
En la histopatología de la pieza quirúrgica se informó melanoma desmoplásico mixto con 20% de componente extensivo superficial, focalmente ulcerado, con compromiso de la dermis reticular, Clark: IV, Breslow: 4.1 mm, recuento mitótico menor a una mitosis por mm2 (Fig. 2C).
No se observó compromiso linfovascular, perineural, ni fenómenos de regresión, con márgenes libres de lesión.
Se realizó inmunomarcación con los siguientes resultados: CD34: negativo, Melan A: positivo, HMB45-SOX
10: positivo débilmente, S100: positivo (Fig. 2B) y KI67: fracción proliferativa del 15%.
Los estudios de estadificación, laboratorio con LDH, PET/TC y resonancia con contraste de cerebro, resultaron sin alteraciones significativas.
Uno de los autores (MM) indicó radioterapia postquirúrgica por la variedad clínica, grosor importante y
presencia de ulceración, pero la paciente (médica) junto con el oncólogo decidieron no realizarla.
La paciente se encuentra dentro de los 12 meses de seguimiento por servicio de oncología y dermatología
cada 3 meses, sin evidencia de recidivas.
Caso clínico 2
Hombre de 77 años con antecedente de melanoma en dorso en 1999, tratado en esa oportunidad en otro centro, no contaba con la anatomía patológica, se le realizó tratamiento quirúrgico.
Consultó en nuestro servicio en julio de 2017 por presentar una nueva lesión en región escapular izquierda de al menos 3 meses de evolución, con crecimiento progresivo. Al examen físico se pudo observar intenso fotodaño y un tumor pigmentado, de coloración azul negruzco, de 2 × 1.5 cm, sobreelevado, con superficie y bordes irregulares, indurado. No se palpaban adenopatías (Fig. 1B).
En la biopsia se observó un melanoma extensivo superficial en fase de crecimiento vertical, no ulcerado, con sectores desmoplásicos en el 50% del componente profundo del tumor. Breslow: 6.3 mm, Clark V. Bajo recuento mitótico, sin compromiso vascular ni perineural, sin signos de regresión y con moderado infiltrado linfocitario intratumoral (Fig. 2D).
En el estudio de TAC/PET no se encontraron metástasis.
Se hizo ampliación de márgenes a 3 cm y biopsia de ganglio centinela, que fue negativa.
El paciente concurrió a control recién un año después de la extirpación quirúrgica, quedando pendientes los resultados de sus controles por imágenes y su respuesta a la propuesta de tratamiento adyuvante con radioterapia. Sin embargo, no volvió a concurrir a la consulta por lo que no pudo ser evaluado ni seguido por los profesionales de nuestro servicio.
Discusión
El MD posee gran variabilidad en su presentación clínica, que suele ser inespecífica. Usualmente son placas, nódulos indurados o lesiones que simulan una cicatriz con ausencia de pigmento, como se observó en nuestra paciente del Caso 1, hallándose, en ocasiones, en forma contigua un melanoma no desmoplásico asociado1, 2. Ambos pacientes presentaron un melanoma no desmoplásico asociado sobre un terreno con extenso fotodaño como se puede apreciar en las Figuras 1A y 1B.
La distribución de estas lesiones en la piel puede estar relacionada con la exposición solar crónica, hallándose en el 51% de los casos en cabeza y cuello, 30% en las extremidades y 17% en el tronco 1.
La utilidad de la dermatoscopía en el diagnóstico de los MD está en discusión debido a la limitada información sobre las características dermatoscópicas de estos tumores.
Asimismo, la regla del ABCDE (A: Asimetría, B: Bordes irregulares, C: Color, D: Diámetro, E: Evolución) para identificación de las señales de advertencia del melanoma no son de utilidad en estos tipos de melanoma debido a que no se presentan como una lesión névica habitual.
El elemento distintivo histológico del MD es la presencia en la dermis de melanocitos atípicos fusiformes, dispersos en un estroma de colágeno prominente (desmoplasia).
Las células neoplásicas suelen ser no pigmentadas y el grado de atipia es variable4. En el 80% al 85% de los casos se identifica un componente de melanoma in situ asociado 5. El melanoma lentigo maligno (MLM) es el tipo más común de melanoma asociado, seguido del melanoma extensivo superficial (MES), como se observó en nuestros pacientes, que se asoció en ambos casos a un MES. Así, según varios autores, tendríamos 2 posibilidades en la histogénesis: el MD que surge por diferenciación a partir de un melanoma maligno (MM) convencional de tipo MLM o MES y los otros casos donde no hay un MM convencional asociado, en los cuales el MD puede haberse desarrollado primariamente en dermis (de novo) o el componente superficial puede haber sufrido regresión 4.
En cuanto a las variantes MDm y MDp, en la literatura encontramos una definición aceptada en el libro de tumores de la OMS, 2018. Se considera MDp al que tiene más de 90% de componente desmoplásico, mientras que el mixto combina focos de melanoma desmoplásico de entre 10 y 90%, con áreas compatibles con MM no desmoplásico 6, 7. En la paciente del Caso 1 el componente desmoplásico correspondía casi a la totalidad del tumor (80%) y en el Caso 2 al 50%, siendo ambos casos de esta forma definidos como un MDm. La clínica de estas lesiones concuerda con la histología: podemos observar el componente de MM no desmoplásico más marcado en el Caso 2 (pigmentado) y un componente casi puramente desmoplásico en el Caso 1, con ausencia de pigmento (Figs. 1A y 1B).
El compromiso neural es un hallazgo frecuente pero no constante en el MD (tanto en MDp como en MDm) y generalmente se asocia a una infiltración tumoral profunda.
Las publicaciones más recientes indican que el MD no siempre es neurotropo y que, además, puede encontrarse neurotropismo en melanomas no desmoplásicos 4. Asimismo, se describe que la presencia de neurotropismo no se ha asociado con peor supervivencia, pero sí con alta recurrencia local 1, 6. Ninguno de nuestros pacientes presentó compromiso perineural en la histología de sus lesiones. Asimismo, a pesar de no haber recibido radioterapia, la paciente del Caso 1 continua libre de recurrencias a la fecha, posiblemente vinculable a esta ausencia de compromiso neural.
El diagnóstico diferencial histológico es con lesiones benignas como: nevo melanocítico esclerosante, cicatriz dérmica, dermatofibroma, neurofibroma y fibroma pleomórfico. Y con lesiones malignas como el carcinoma sarcomatoide, el carcinoma de células escamosas esclerosante de células fusiformes, dermatofibrosarcoma protuberans y algunos otros sarcomas 1, 2.
En estos casos suele ser útil la aplicación de métodos inmunohistoquímicos para una óptima evaluación de la profundidad del tumor y para el diagnóstico diferencial con otros tipos histológicos. Plaza y col. analizaron 40 casos con un panel de marcadores inmunohistoquímicos y concluyeron que S-100p, WT1, SOX10, p75 y nestina constituían el panel óptimo con la más sensible y específica combinación de tinción inmunológica disponible para el diagnóstico de MD 8.
En la revisión de la literatura se hallan opiniones controvertidas en relación a la conducta a adoptar con los ganglios linfáticos regionales. Pace y col. informan en su estudio sobre 28 pacientes con MD que 5 (18%) de ellos desarrollaron una propagación regional de la enfermedad en algún momento de su tratamiento, siendo 1 de cada 9 ganglios centinelas regionales positivo (11%). Sin embargo, concluyen que el estudio de ganglio centinela debería realizarse de acuerdo con los estándares corrientes para el melanoma cutáneo 9.
Con respecto a la diferenciación histológica y el compromiso regional de los MDp y MDm, varios estudios sugieren que el MDp tiene una expectativa de incidencia de metástasis locales baja. Sin embargo, la posibilidad aumenta en los MDm 10, 11.
Otro aspecto interesante del MD es el espesor de Breslow elevado que se describe al momento del diagnóstico.
Sin embargo, si se lo compara con melanomas no desmoplásicos de igual grosor, la posibilidad de metástasis ganglionares es menor 5.
El MD tiene una incidencia de recidiva local de 11% a 40%, muy elevada en comparación con todos los otros subtipos de melanoma, con un Breslow mayor a 4 mm, que es alrededor de un 7.6%. Por presentar una predilección a la recurrencia local y neurotropismo, las guías terapéuticas vigentes indican un margen quirúrgico mínimo de 2 cm para estos tumores, incluso si la lesión es relativamente fina 1, 9.
El uso de la radioterapia, quimioterapia adyuvante y la inmunoterapia en estos tipos de tumores no ha sido suficientemente estudiado. Los estudios que se publican generalmente están constituidos por un número reducido de casos, lo que no permite establecer un lineamiento científico adecuado.
En las guías de tratamiento del melanoma cutáneo publicadas en enero 2019 se sugiere radioterapia adyuvante después de una amplia extirpación para el melanoma desmoplásico con características de alto riesgo (p. ej.: espesor de Breslow mayor a 4 mm, nivel de Clark V, neurotropismo extenso/invasión perineural, ubicación de la cabeza y el cuello y/o resección del margen profundo estrecho) 12.
Actualmente, el estudio en Fase 3 de investigación NCT00975520 compara la cirugía sola con la cirugía y radioterapia postquirúrgica en pacientes con resección amplia de melanoma neurotrópico de cabeza y
cuello, lo que brindará información importante para la toma de decisiones futuras en el tratamiento de
estos tumores 13.
Las metástasis sistémicas ocurren en 7 a 44% de los pacientes con MD con mayor compromiso de pulmón, hígado y huesos 1. El tratamiento sistémico con terapias inmunodirigidas como el ipilimumab, el pembrolizumab y el nivolumab continúan en evaluación. La elevada carga mutacional encontrada en estos tumores ha validado el uso de los anti PD1, con resultados promisorios 14. Por el contrario, el hallazgo de mutaciones de BRAF es de alrededor del 10%, limitando la utilidad de las terapias dirigidas a dicha vía 5.
En conclusión: el diagnóstico temprano del MD se dificulta debido a su presentación clínica variable, con
predominio del componente dérmico y la frecuente ausencia de pigmento. Es importante estar atentos ante la observación de lesiones dérmicas de aspecto cicatrizal, a veces con ausencia de pigmento acompañante, que aparecen sobre un terreno con excesivo fotodaño, en forma espontánea, y muestran crecimiento progresivo, para poder derivar estos casos a un dermatólogo entrenado para el manejo de esta entidad.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Chen LL, Jaimes N, Barker CA, Busam KJ, Marghoob AA. Desmoplastic melanoma: a review. J Am Acad Dermatol 2013; 68: 825-33.
2. Andreevscaia O, Theate I, Goosens C, Vanhooteghem O. Diagnostic challenge of desmoplastic melanoma. Rare Tumors 2016; 8: 5713.
3. Hawkins WG, Busam KJ, Ben-Porat L, et al. Desmoplastic melanoma: A pathologically and clinically distinct form of cutaneous melanoma. Ann Surg Oncol 2005; 12: 207-13.
4. Bastos Junior C de S, Piñeiro-Maceira JM, Moraes FM. Desmoplastic melanoma associated with an intraepidermal lentiginous lesion: case report and literature review. Ann Bras Dermatol 2013; 88: 408-12.
5. Busam KJ, Mujumdar U, Hummer AJ, et al. Cutaneous desmoplastic melanoma: reappraisal of morphologic
heterogenicity and prognostic factors. Am J Surg Pathol 2004; 28:1518-25.
6. Busam KJ. Desmoplastic melanoma. Clin Lab Med 2011; 31: 321-30.
7. Scolyer RA, Barnhill RL, Bastian BC, Busam KJ, McCarthy SW. Desmoplastic melanoma. En: Elder DE, Massi D, Scolyer RA, Willemze R (eds.). WHO classification of skin tumours, 4th ed. Lyon: IARC, 2018, p 105-7.
8. Plaza JA, Bonneau P, Prieto V, et al. Desmoplastic melanoma: an updated immunohistochemical analysis of 40 cases with a proposal for an additional panel of stains for diagnoses. J Cutan Pathol 2016; 43: 313-23.
9. Pace CS, Kapil JP, Wolfe LG, Kaplan BJ, Neifeld JP. Des moplastic melanoma: Clinical behavior and management implications. Eplasty 2016; 16: e3.
10. Han D, Zager JS, Yu D, et al. Desmoplastic melanoma: ¿Is there a role for sentinel lymph node biopsy? Ann Surg Oncol 2013; 20: 2345-51.
11. Han D, Han G, Zhao X, et al. Clinicopathologic predictors of survival in patients with desmoplastic melanoma. PloS One 2015; 10: e0119716.
12. Swetter SM, Tsao H, Bichakjian CK, et al. Guidelines of care for the management of primary cutaneous melanoma. J Am Acad Dermatol 2019; 80: 208-50.
13. ClinicalTrials.gov (internet). National Library of medicine (US). 29 Feb 2000. Identifier NCT00975520, Neurotropic melanoma of the head and neck (RTN2). September 10, 2009. En: https://clinicaltrials.gov/ct2/show/NCT00975520?term=A+Randomised+Trial+of+Postoperative+Radiation+Therapy+Following+Wide+Excision+of+Neurotropic+Melanoma+of+the+Head+and+Neck+%28RTN2%29&rank=1; consultado septiembre 2019.
14. Eroglu Z, Zaretsky JM, Hu-Lieskovan S, et al. High response rate to PD-1 blockade in desmoplastic melanomas. Nature 2018; 553: 347-50.
– – – –
Example is not the main thing in influencing others; it is the only thing.
El ejemplo no es lo principal para influenciar a los demás; es lo único.
Albert Schweitzer (1875-1965)
