DANIEL GUILLÉN PINTO1, 3, PILAR MEDINA ALVA2, 3
1Hospital Cayetano Heredia, 2Instituto Materno Perinatal de Lima, 3Universidad Peruana Cayetano Heredia, Perú
sitorios. Sin embargo, por su intensidad pueden ser confundidos como verdaderas crisis epilépticas. El objetivo de esta revisión es actualizar los conceptos en relación a los temblores, mioclonías neonatales benignas del sueño (MNBS) e hiperecplexia. Los temblores son muy frecuentes, una vez identificados debe determinarse si pertenecen a un síndrome de hiperexcitabilidad relacionado con factores maternos o perinatales, en casos idiopáticos se espera buen pronóstico. Las MNBS con frecuencia se confunden con crisis epilépticas, se caracterizan porque las mioclonías son breves y solo se presentan en el sueño, los niños son normales y el EEG también es normal. La hiperecplexia es un trastorno raro, genéticamente determinado, caracterizado por hipertonía y reacciones de sobresalto exagerado ante un estímulo banal, que pueden mejorar con clonazepam.
events in the neonate, generally transient. However, due to their intensity they can be confused as true epileptic seizures. The objective of this review is to update the concepts in relation to tremors, neonatal benign sleep myoclonus (MNBS) and hyperekplexia. The tremors are very frequent, once identified it must be determined if they belong to a hyperexcitability syndrome related to maternal or perinatal factors, in idiopathic cases a good prognosis is expected. MNBS are often confused with epileptic seizures. They are characterized by the fact that myoclonus is brief and occurs only in sleep, children are normal, and the EEG is also normal. Hyperekplexia is a rare, genetically determined disorder characterized by hypertonia and exaggerated startle reactions to a banal stimulus, which can be improved with clonazepam.
e-mail: dguillenpinto@gmail.com
En los niños es muy importante diferenciar los paroxismos epilépticos de los no epilépticos para evitar engorrosos exámenes, excesivos tratamientos y la preocupación innecesaria de los padres1. Particularmente en el neonato sano, tanto en sueño como en vigilia, se presentan una serie de movimientos, gestos y actitudes que son expresión de la maduración del sistema nervioso. Los paroxismos no epilépticos en el neonato (TPNEN) son fenómenos transitorios caracterizados por su frecuencia e intensidad variable que pueden presentarse como flexiones, extensiones, sacudidas, temblores y gestos durante las primeras semanas de vida2. En ocasiones, estos paroxismos pueden confundirse con verdaderas crisis epilépticas, ser expresiones de algunos trastornos metabólicos o manifestaciones mediadas por tóxicos1, 2. Por tanto, se deberá tener claro conocimiento de las diferentes formas clínicas de TPNEN de acuerdo a la edad. En adelante revisaremos las condiciones más frecuentes en el neonato, en las que incluimos los temblores, las mioclonías benignas del sueño y la hiperecplexia1, 2.
Temblores
El temblor neonatal es un fenómeno frecuente. Este trastorno consiste en movimientos rítmicos e involuntarios, generalmente localizados alrededor de un eje fijo y que pueden ser contenidos con la sujeción o la flexión pasiva de la extremidad afectada3. El temblor ha sido descrito en una proporción alta de neonatos, llegando a valores de 44% en los primeros estudios de observación de bebés sanos4. El término anglosajón jitteriness se acuñó para describir de forma indistinta cualquier tipo de temblor, independientemente de su etiología o características y se emplea hasta la actualidad.
Cuando un bebé llora intensamente puede mostrar temblores, los cuales usualmente tienen una alta frecuencia (seis o más veces por segundo) y una baja amplitud (menor a 3 cm). Este temblor “fino” se asocia con frecuencia al llanto y cede con la sujeción de la extremidad afectada y con la succión5. En la mayoría de los casos el temblor será el síntoma único y su causa no podrá ser identificada. Es común que los temblores finos se acompañen de hiperactividad, bajo umbral para las respuestas reflejas y reflejo de Moro de fácil aparición, conformando el síndrome de hiperexcitabilidad neonatal descrito inicialmente por Prechtl y Beintema6. En una serie de 936 pacientes se encontró además que son menos consolables, con menor capacidad de seguimiento visual, hipertonía (en el 34%) e hiperreflexia (en el 52%). Con mayor frecuencia eran pacientes con peso bajo, tenían más de 12 horas de vida y no estuvieron expuestos a anestesia general3.
Los temblores intensos, por el contrario, presentan una menor frecuencia (menor a 6 veces por segundo) y una mayor amplitud (rango de movimiento mayor a 3 cm)5. Berger describió una serie de 30 recién nacidos a término con temblores intensos sin causa aparente, en quienes observó la persistencia de los mismos con características leves durante un período de dos a seis meses, principalmente limitados al mentón. De manera interesante, en este grupo con temblores ostensibles, los antecedentes maternos fueron más comunes (preeclampsia, parto distócico, retraso de crecimiento intrauterino, entre otros). Se encontraron casos con temblor familiar persistente, dos de estos niños presentaron crisis epilépticas en el seguimiento7. Los temblores intensos pueden aparecer con los trastornos metabólicos (hipoglicemia, hipocalcemia, abstinencia a drogas), problemas sistémicos (infecciones, enfermedad tiroidea) o enfermedades neurológicas (encefalopatía hipóxico-isquémica, hemorragia intraventricular, hemorragia subgaleal).
Parker y col. propusieron la clasificación del temblor neonatal en tres grados: leve, si aparece solo cuando el bebé está llorando; moderado, cuando aparece durante la vigilia y grave, cuando aparece en diferentes niveles de la conciencia, particularmente cuando el bebé está tranquilo y despierto4. En forma general se puede decir que el temblor neonatal aparece en dos grupos de pacientes: aquellos sin enfermedad neurológica y aquellos con alguna condición que produce irritabilidad neuronal5.
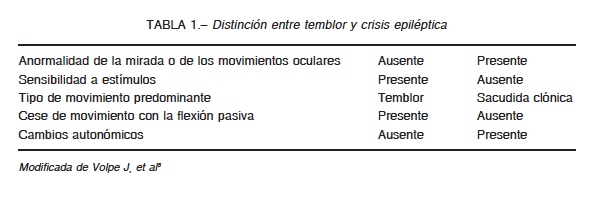
Volpe describió algunas características que permiten distinguir al temblor de la crisis epiléptica, especialmente la crisis de tipo clónico o mioclónico, con las cuales puede ser confundido. En comparación con las crisis clónicas, los temblores suelen ser de mayor frecuencia y de menor amplitud, mientras que en las crisis clónicas existe un movimiento rápido seguido de un movimiento lento de rebote (Tabla 1)8. En cuanto a la frecuencia, Shuper y col. describieron el inicio de los temblores después del primer día de vida en casi 58% de casos. Los temblores se resolvieron en un periodo promedio de 7.2 meses, siendo mayor el tiempo si el temblor se acompaña de hiperexcitabilidad. No existen diferencias significativas entre los bebés que empezaron el primer día y los que empezaron después3.
Es posible que la causa de los temblores no sea reconocida después de una evaluación inicial extensa. Sims y col. postularon que existiría un incremento de la actividad adrenérgica, y demostró la existencia de niveles séricos más altos de norepinefrina en bebés a término con temblores, mientras los niveles de epinefrina eran comparables a bebés asintomáticos9. La generación de los temblores podría implicar mecanismos de origen central y periférico. Un incremento en la sensibilidad del terminal aferente del huso muscular puede producir una contracción breve del músculo y así dar lugar al temblor. Con la maduración progresiva de los tractos inhibitorios, esta sobreactividad desaparecería progresivamente3.
Los factores asociados a la aparición de temblores se muestran en la Tabla 210. Son de interés los antecedentes maternos y perinatales, donde se debe explorar el uso de sustancias o fármacos en la madre, diabetes, tirotoxicosis, sepsis, hemorragia, uso de anestesia, dificultades en el parto, signos de distrés fetal y de insuficiencia placentaria. Los temblores se han descrito en 75% de bebés prematuros nacidos de madres preeclámpticas, y la administración de sulfato de magnesio no pareció afectar su incidencia11.
El consumo materno de fármacos y drogas merece especial atención, habiéndose comunicado mayor incidencia de temblores e hiperexcitabilidad en los hijos de gestantes que hayan empleado inhibidores de recaptación de serotonina (fluoxetina, fluvoxamina, sertralina), haloperidol, benzodiacepinas, opiáceos, cannabinoides y cocaína. La exposición fetal a estas sustancias provoca la aparición de síndromes de hiperexcitabilidad asociados o no a síndromes de abstinencia. Shiromura y col. sugieren que la exposición a ciertas drogas como haloperidol podría provocar alteraciones en el sueño REM del recién nacido

en los primeros días de vida, mediadas por receptores de dopamina, alterando así la maduración cerebral durante este período12.
Los hábitos de alimentación materna también deben ser investigados en la exploración inicial. En la literatura médica existen informes de bebés con hiperexcitabilidad atribuidas al consumo materno de cafeína, chocolate13 y yerba mate, de uso común en algunas regiones de Sudamérica14. El cuadro también se ha atribuido recientemente a deficiencia congénita de vitamina D15. El consumo de anís estrella como carminativo es una causa común en algunas sociedades16. Asimismo, debería considerarse el riesgo de exposición a metales pesados y pesticidas en poblaciones de riesgo ambiental17.
Los estudios de seguimiento han mostrado que el paciente tembloroso sin historia perinatal de riesgo tiene evolución favorable. Para la edad de 9 meses el 70% de ellos muestra desaparición de los temblores, y a los dos años presentan desarrollo normal18. Por otro lado, los bebés con factores de riesgo perinatales tienen un riesgo de 30% de presentar trastornos en el neurodesarrollo, con especial atención en aquellos que mostraron todo el cortejo de síntomas del síndrome de hiperexcitabilidad1.
Mioclonías benignas del sueño del neonato
La primera descripción de las mioclonías neonatales benignas del sueño (MNBS) data de 1982, descrita por Coulder y Allen en tres neonatos saludables. Desde entonces, se han comunicado series de casos de varios países y aunque no se conoce su verdadera prevalencia, se presume que no son raras y que predominan en el sexo masculino19,20. Sin embargo, pocas veces se tiene presente en las salas de neonatología, posiblemente confundidos como verdaderas crisis epilépticas neonatales21.
En todas las series de casos se informa que la MNBS afecta neonatos a término (96%) o casi a término (4%)20. En la experiencia de Paro-Panjan y col., con 38 pacientes, solo dos tuvieron 36 semanas gestacionales y en la publicación de Goraya y col. refieren que el 83% eran neonatos a término21, 22. Aunque no se ha dado una explicación al respecto, lo más probable sea que las MBSN dependan de mecanismos madurativos que no se presentan en cerebros muy inmaduros.
Generalmente, las mioclonías se inician en neonatos menores de dos semanas. Di Capua y col. observaron en 12 niños que el inicio sucedía entre 1 a 15 días de edad, con un promedio de 6.3 días23, aunque menos frecuentemente pueden iniciar hasta las 8 semanas de vida21,24. Luego tienden a aumentar las sacudidas hasta la tercera y cuarta semana, y posteriormente declina la frecuencia y suelen desaparecer en el 95% antes de los 6 meses de edad20, 22, 23, 25. Las mioclonías se presentan preferentemente durante el sueño NREM, en series de 20 a 30 por minuto y duran en promedio menos de una hora20, 26.
El desorden está caracterizado por sacudidas mioclónicas durante el sueño. Clínicamente son mioclonías bilaterales en sueño NREM, fases III y IV23, que cesan por completo al despertar. Las mioclonías suelen comprometer los brazos y piernas, y pueden ser sincrónicas o asincrónicas. Son generalmente multifocales o generalizadas, y menos frecuentemente pueden ser focales. Raramente se observan en la cara, cabeza y abdomen23,24. También se ha descrito que algunos estímulos como los sonidos, balanceo o viajar en coche pueden inducir su presentación.
Kaddurah y Holmes en una serie de 18 pacientes del Líbano, observaron que 4 neonatos fueron derivados con tratamiento antiepiléptico y 14 para evaluación, todos fueron neonatos a término, y entre sus conclusiones refiere que las MNBS no son tan infrecuentes, que pueden ser preferentemente lateralizadas y ocurrir en la transición al despertar19. Estas particularidades también han sido informadas por otros autores, destacando la frecuencia con que suelen confundirse con crisis epilépticas hasta en 33% de los casos26.
Típicamente el registro electroencefalográfico (EEG) crítico es normal. Sin embargo, en la actualidad, se prefiere la video-electroencefalografía para asegurar el diagnóstico de MBSN27. Entre el diagnóstico diferencial, inicialmente se tendrán en cuenta los temblores, las crisis sintomáticas (hipoglicemia, hipocalcemia, meningitis, hemorragias, deficiencia de piridoxina, abstinencia a drogas) y la hiperecplexia. Otras condiciones menos frecuentes durante los primeros días de vida son la epilepsia neonatal familiar benigna y las crisis idiopáticas neonatales, en ambas el examen neurológico y el EEG intercrítico son normales, pero el EEG ictal es anormal. Más tardíamente, la encefalopatía mioclónica temprana y la encefalopatía epiléptica infantil temprana son graves síndromes epilépticos en los que siempre el examen neurológico y el EEG son anormales20.
El curso clínico de las MNBS es benigno y las mioclonías desaparecen sin deterioro del desarrollo, en seguimiento clínico hasta por 5 años20, 25. Esta aseveración no exime que se hayan comunicado mínimos hallazgos que no difieren de la frecuencia en la población sin MBSN22. Por tanto, estos neonatos no requieren ningún tratamiento, y contrariamente se ha observado que las benzodiacepinas podrían aumentar la frecuencia de las mioclonías26.
El mecanismo de MNBS no es conocido, pero se ha postulado que puede originarse por un desbalance en el sistema serotoninérgico y en la activación del sistema reticular25. En recientes años se ha publicado que puede haber herencia autosómica dominante relacionada con la migraña y que no están relacionados los genes KCNQ2 y KCNQ328.
Hiperecplexia
La hiperecplexia, también conocida por la enfermedad del sobresalto desde 1958, es un raro desorden conocido por la exagerada respuesta ante un estímulo inesperado1,2. Puede ocurrir en forma esporádica o ser hereditaria. En la segunda condición es autosómica dominante, aunque también se ha descrito enfermedad recesiva, cuyo defecto principal se ubica en el brazo largo del cromosoma 529. La forma hereditaria es heterogénea. En 1993 se identificó la mutación para el gen de la subunidad 1-alfa del receptor de glicina (GLRA 1), que sigue siendo la forma más frecuente. Sin embargo, ya se han comunicado cuatro nuevas mutaciones, GPHN, ARH-GEF9 y SLC6A5, todas relacionadas con el metabolismo de la glicina29.
La hiperecplexia hereditaria se inicia en el período perinatal y la presentación más frecuente es la respuesta exagerada a la estimulación de la punta de la nariz. Se describen como desencadenantes los estímulos sonoros, táctiles, visuales y vestibulares. Los bebés presentan expresión de miedo y contracción de la cara, flexión de la cabeza y de los hombros, aducción de los brazos, flexión del tronco y de las piernas, y finalmente pérdida del tono muscular, semejante al reflejo de Moro. El niño puede parecer hipotónico durante el sueño y desarrolla rigidez al despertar y los reflejos osteotendinosos generalmente son exagerados. El EEG es normal30.
El síndrome de muerte súbita puede ocurrir por apnea central relacionada con disfunción troncal o por apnea periférica secundaria a laringoespasmo, aspiración o bloqueo cardíaco30. La rigidez mejora con la edad, y a los 3 años los niños pueden parecer normales. Pero los episodios de rigidez tienden a recurrir hacia la adolescencia o adultez en relación a súbitos estímulos, frío o gestación. El intelecto es normal y los pacientes generalmente responden a bajas dosis de clonazepam, además del ácido valproico y levetiracetam30.
Otros eventos no epilépticos
Excepto por la apnea del prematuro, existen otros eventos infrecuentes como reflujo gastroesofágico intenso o síndrome de Sandifer que se inicia con frecuencia al final del primer mes de vida, en ocasiones relacionado con alergia a la proteína de leche de vaca. Otros eventos menos frecuentes son el desorden de dolor extremo (síndrome familiar de dolor rectal) que se caracteriza por enrojecimiento, seguidas de rigidez o posturas tónicas con llanto intenso. Se trata de un desorden autosómico dominante que puede responder a la carbamacepina2. Finalmente, otros menos frecuentes son los espasmos diafragmáticos, las manifestaciones autonómicas, rotación de los ojos y los movimientos orolinguales como succión, masticación, y las protrusiones linguales2.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Huntsman RJ, Lowry NJ, Sankaran K. Nonepileptic motor phenomena in the neonate. Paediatr Child Health 2008; 13: 680-4.
2 Cross JH. Differential diagnosis of epileptic seizures in infancy including the neonatal period. Semin Fetal Neonatal Med 2013; 18: 192-5.
3. Shuper A, Zalzberg J, Weitz R, Mimouni M. Jitteriness beyond the neonatal period: a benign pattern of movement in infancy. J Child Neurol 1991; 6: 243-5.
4. Parker S, Zuckerman B, Bauchner H, Frank D, Vinci R, Cabral H. Jitteriness in full-term neonates: prevalence and correlates. Pediatrics 1990; 85: 17-23.
5. García-Alix A, García-Alix J, Quero J. Evaluación neurológica del recién nacido. Madrid: Díaz de Santos, 2012. En: http://site.ebrary.com/id/10592391; consultado junio 2018.
6. Prechtl HFR. The neurological examination of the full term newborn infant: a manual for clinical use from the Department of Developmental Neurology (2nd ed). Clinics in developmental medicine. London: William Heinemann Medical Books Ltd., 1977, p 68.
7. Berger A, Sharf B, Winter ST. Pronounced Tremors in Newborn Infants: Their Meaning and Prognostic Significance: A Long-Term Follow-Up Study of 30 Such Infants. Clin Pediatr (Phila) 1975; 14: 834-5.
8. Volpe J, Inder T, Darras B, et al. Volpe’s neurology of the newborn (6th ed). Philadelphia, PA: Elsevier, 2018, p 1224.
9. Sims M, Artal R, Quach H, Wu PY. Neonatal jitteriness of unknown origin and circulating catecholamines. J Perinat Med 1986; 14: 123-6.
10. Akierman A, Shukla A. Normal newborns: special problems during the first three days of life. Can Fam Physician 1990; 36: 1523-8.
11. Ozkan H, Anal O, Turan A, Giray O. Maternal preeclampsia and jitteriness in preterm infants. Pediatr Int 1999; 41: 557-60.
12. Shimohira M, Iwakawa Y, Kohyama J. Rapid-eye-movement sleep in jittery infants. Early Hum Dev 2002; 66: 25-31.
13. Cambria S, Manganaro R, Mamì C, Marseglia L, Gemelli M. Hyperexcitability syndrome in a newborn infant of chocoholic mother. Am J Perinatol 2006; 23: 421-2.
14. Martín I, López-Vílchez MA, Mur A, et al. Neonatal withdrawal syndrome after chronic maternal drinking of mate. Ther Drug Monit 2007; 29: 127-9.
15. Collins M, Young M. Benign neonatal shudders, shivers, jitteriness, or tremors: early signs of vitamin D deficiency. Pediatrics 2017; 140: e1-5.
16. Ize-Ludlow D, Ragone S, Bruck IS, Bernstein JN, Duchowny M, Peña BMG. Neurotoxicities in infants seen with the consumption of star anise tea. Pediatrics 2004; 114: e653-6.
17. Olympio KPK, Gonçalves CG, Salles FJ, et al. What are the blood lead levels of children living in Latin America and the Caribbean? Environ Int 2017; 101: 46-58.
18. Leone D, Brogna C, Ricci D, et al. Development of clinical signs in low risk term born infants with neonatal hyperexcitability. Early Hum Dev 2013; 89: 65-8.
19. Kaddurah AK, Holmes GL. Benign neonatal sleep myoclonus: history and semiology. Pediatr Neurol 2009; 40: 343-6.
20. Maurer VO, Rizzi M, Bianchetti MG, Ramelli GP. Benign neonatal sleep myoclonus: a review of the literature. Pediatrics 2010; 125: e919-24.
21. Goraya JS, Singla G, Mahey H. Benign neonatal sleep myoclonus: frequently misdiagnosed as neonatal seizures. Indian Pediatr 2015; 52: 713-4.
22. Paro-Panjan D, Neubauer D. Benign neonatal sleep myoclonus: experience from the study of 38 infants. Eur J Paediatr Neurol 2008; 12: 14-8.
23. Di Capua M, Fusco L, Ricci S, Vigevano F. Benign neonatal sleep myoclonus: clinical features and video-polygraphic recordings. Mov Disord 1993; 8: 191-4.
24. Resnick TJ, Moshé SL, Perotta L, Chambers HJ. Benign neonatal sleep myoclonus. Relationship to sleep states. Arch Neurol 1986; 43: 266-8.
25. Suzuki Y, Toshikawa H, Kimizu T, et al. Benign neonatal sleep myoclonus: our experience of 15 Japanese cases. Brain Dev 2015; 37: 71-5.
26. Caraballo R, Yépez I, Cersósimo R, Fejerman N. Mioclonías neonatales benignas del sueño. Rev Neurol 1998; 2: 540-4.
27. Kim SH, Kim H, Lim BC, Chae J-H, Kim KJ, Hwang YS, et al. Paroxysmal nonepileptic events in pediatric patients confirmed by long-term video-EEG monitoring–Single tertiary center review of 143 patients. Epilepsy Behav 2012; 24: 336-40.
28. Afawi Z, Bassan H, Heron S, et al. Benign neonatal sleep myoclonus: an autosomal dominant form not allelic to KCNQ2 or KCNQ3. J Child Neurol 2012; 27: 1260-3.
29. Giménez C, Zafra F, López-Corcuera B, Aragón C. Bases moleculares de la hyperecplexia hereditaria. Rev Neurol 2008; 47: 648-52.
30. Praveen V, Patole SK, Whitehall JS. Hyperekplexia in neonates. Postgrad Med J 2001; 77: 570–2.
