MARÍA J. MELA OSORIO ¹, ISABEL A. GIERE ², ISOLDA FERNÁNDEZ ¹, MIGUEL A. PAVLOVSKY ¹,
DANTE INTILE ³, CAROLINA PAVLOVSKY ¹
¹ Servicio de Hematología e Investigación Clínica, ² Laboratorio de Citogenética y Biología Molecular,
³ Servicio de Clínica Médica, Fundación para Combatir la Leucemia (FUNDALEU),
Centro de Internación e Investigación Clínica, Buenos Aires, Argentina
Resumen La supervivencia a cinco años de los pacientes con leucemia mieloide crónica en fase crónica tratados con inhibidores de tirosina quinasa es superior al 90%. Existen escasos datos a nivel local. Esta información puede ser de interés, ya que el imatinib genérico se encuentra disponible en la región. El objetivo del presente estudio es proporcionar información del monitoreo y los resultados a largo plazo del tratamiento con imatinib fuera de un ensayo clínico controlado, así como analizar el valor predictivo de respuestas tempranas para el logro de respuesta molecular 4.0 y la detección de variables que puedan condicionar falla al tratamiento. Se incluyeron 106 pacientes tratados con imatinib 400 mg diarios como inhibidor de primera línea durante una mediana de 8.9 años IQR (5.8-11.7) entre junio del 2000 y diciembre del 2015. La supervivencia global fue de 93%. En la última evaluación, 74% de los pacientes continuaba recibiendo el imatinib inicial. La obtención de respuesta en los objetivos temporales específicos (6, 12 meses) se asoció con mayor supervivencia libre de falla: 87% vs. 56%, p = 0.007; 90% vs. 69% p = 0.01 y mayor adquisición de respuesta molecular 4.0: OR 5.6 (IC 95% 1.6-19.0) p = 0.003; OR 5.3 (IC 95% 1.4-21.0) p = 0.006. Luego del prolongado seguimiento, el imatinib proporcionó altas tasas de respuesta y supervivencia. Se confirmó el valor pronóstico de la respuesta en momentos temporales específicos. Este estudio refuerza la importancia del monitoreo estandarizado en los puntos temporales conocidos, que debe continuar siendo un objetivo en Argentina.
Palabras clave: leucemia mieloide crónica, BCR-ABL positiva, mesilato de imatinib
Abstract Chronic myelogenous leukemia: monitoring and predictors of a favorable response to treatment with imatinib. The expected five-year survival of chronic-phase chronic myeloid leukemia patients treated with tyrosine kinase inhibitors is over 90%. Little data is available regarding the results in the Argentinian population. This information might be of interest as generic imatinib is now available in the region. The aim of this study is to provide information on monitoring and the long-term treatment with imatinib outside of a controlled clinical trial, as well as to analyze the predictive effect of early responses to achieve molecular remission 4.0 (RM 4.0) and the detection of variables that may condition treatment failure. We included 106 patients, who received imatinib 400 mg daily as first-line inhibitor for a median of 8.9 years (IQR 5.8-11.7) between June 2000 and December, 2015. Overall survival was 93%. At latest follow-up 74% of patients continues on initial imatinib. The achievement of response at targeted milestones (6, 12 months) was associated with increased failure-free survival: 87% vs. 56%, p = 0.007; 90% vs. 69% p = 0.01 and was independently associated to RM 4.0: OR 5.6 (95% CI: 1.6-19.0); OR 5.3 (95% CI: 1.4-21.0) p = 0.006. After long-term follow-up, imatinib provided high-rates of response and survival. The prognostic value of response at targeted milestones was confirmed. This study reinforces the importance of molecular monitoring under IS standardization at known timepoints and this must continue to be a target in Argentina.
Key words: chronic myelogenous leukemia, BCR-ABL positive, imatinib mesylate
Recibido: 13-IX-2016 Aceptado: 22-III-2017
Dirección postal: María J. Mela Osorio, Fundación para Combatir la Leucemia (FUNDALEU), J. E. Uriburu 1450, 1114 Buenos Aires, Argentina
e-mail: mjmela@fundaleu.org.ar
La terapia con inhibidores de tirosina quinasa (ITK) tiene excelente eficacia en el tratamiento de pacientes con leucemia mieloide crónica (LMC). Desde su introducción a fines de la década del 90 ha revolucionado el tratamiento de esta enfermedad. La expectativa de supervivencia global (SG) informada para los pacientes con LMC en fase crónica tratados con ITK es superior al 90%1; sin embargo, existen pocos datos disponibles sobre la experiencia con este tratamiento a nivel local. Los resultados de los pacientes con LMC tratados con imatinib original (Glivec®) como inhibidor de primera línea son de interés ya que el imatinib genérico está ahora disponible en varios países de la región incluyendo la Argentina.
El factor predictivo más importante en LMC es la respuesta obtenida con ITK2. La respuesta óptima se asocia a mejores resultados a largo plazo y la expectativa de vida en esta situación es comparable a la de la población general2. El monitoreo de enfermedad mínima residual por reacción en cadena de la polimerasa cuantitativa en tiempo real (Real time qPCR) en pacientes con LMC es mandatorio en la era de ITK. Múltiples grupos de investigación han publicado sus resultados al respecto en la última década dentro de los cuales se encuentra la experiencia de nuestro centro3. La evaluación citogenética y molecular en puntos de tiempo precoces del tratamiento resultan efectivos indicadores pronósticos tempranos de respuestas duraderas a largo plazo y de supervivencia. El monitoreo molecular cumple un rol esencial para identificar a aquellos pacientes con respuestas no óptimas que podrían beneficiarse con otros tratamientos. Recientemente, alcanzar la remisión libre de tratamiento4 ha comenzado a ser el objetivo del tratamiento en LMC; no obstante, los marcadores predictivos para alcanzar respuestas moleculares profundas no han sido aún completamente dilucidados. El momento óptimo para alcanzar la respuesta molecular mayor (RMM) según recomendación de guías internacionales es a los 12 meses desde el diagnóstico de la LMC, pero no alcanzar RMM no es un criterio de falla en ningún punto de tiempo2.
En el presente estudio presentamos el seguimiento a largo plazo de pacientes con LMC tratados con imatinib original en una institución y analizamos los factores predictivos para alcanzar respuesta molecular 4.0 (RM 4.0). Como objetivo secundario nos propusimos evaluar el riesgo de falla de los que alcanzan RMM posterior al momento sugerido como óptimo.
Materiales y métodos
Entre 2000 y 2015 un total de 122 pacientes adultos con diagnóstico reciente de LMC en fase crónica fueron tratados en FUNDALEU con ITK. De un total de 122, 106 recibieron imatinib 400 mg por día como ITK de primera línea y constituyen la base para este análisis. Se realizó la revisión de historias clínicas de aquellos que recibieron ITK durante tres meses como mínimo.
Las fases crónica, acelerada y blástica fueron definidas acorde a criterios de European Leukemia Net (ELN)5. La estratificación de riesgo se realizó de acuerdo a la puntuación de Sokal6. El estado funcional basal se evaluó con la escala del Eastern Cooperative Oncology Group7. Este estudio fue aprobado por el comité de docencia institucional y está en concordancia con la Declaración de Helsinki.
Se realizó un estudio citogenético de células de médula ósea en metafase al diagnóstico y a los 6 meses de tratamiento con ITK, luego cada 6 meses hasta alcanzar la remisión citogenética completa (RCC), repitiéndose en casos de falla, progresión a fase acelerada o crisis blástica. Aquellas muestras que al mes 6 no presentaban suficientes metafases para el análisis fueron validadas para RCC por respuesta molecular en escala internacional IS% BCR-ABL ≤ 1% según Lauseker y col.8.
El nivel de transcriptos BCR-ABL fue medido en muestra de sangre periférica por PCR en una plataforma 7500 real-time PCR System (Applied Biosystems®, Life Technologies, EE. UU.) según el programa del protocolo Europe against Cancer 9. El monitoreo molecular se inició en la institución en 2005 de acuerdo a guías técnicas publicadas por Hughes y col.10 y desde entonces se utilizó la misma plataforma y condiciones técnicas. Nuestro laboratorio fue estandarizado en la escala internacional (IS) en 2012, por consiguiente, todos los resultados del presente análisis fueron convertidos e informados como IS%BCR-ABL. Se definen respuestas como RCC: ausencia de metafases con cromosoma Filadelfia, RMM: BCR-ABL1 IS ≤ 0.1% y RM 4.0: BCR-ABL1 IS ≤ 0.01% de acuerdo a criterios de ELN2 y enfermedad indetectable con ≥ 10 000 transcriptos ABL1 en todos los duplicados de la misma muestra11. Ante un aumento en el nivel del transcripto, se repitió el ensayo con nueva muestra luego de 30 días para confirmación del resultado y realizar nuevo estudio citogenético en caso de pérdida de RMM.
La SG se calculó desde la fecha del inicio del tratamiento hasta la fecha de muerte por cualquier causa. La supervivencia libre de falla (SLF) se definió como el tiempo desde el inicio del tratamiento con imatinib hasta la fecha de pérdida de RCC, pérdida de respuesta hematológica, fase acelerada, crisis blástica o muerte de cualquier causa durante el tratamiento con imatinib. Las fallas fueron retrospectivamente definidas de acuerdo a los criterios vigentes de ELN2. El tiempo en obtener la respuesta se calculó desde la fecha de inicio del tratamiento con imatinib hasta la primera fecha en que se documentó la respuesta.
Las variables descriptivas fueron expresadas en mediana y rango, o frecuencias y porcentajes según corresponda. Las respuestas en cada punto de tiempo fueron comparadas utilizando análisis de Mann-Whitney, prueba de χ2 o prueba exacta de Fisher. Para el análisis multivariado se consideró RM 4.0 como variable dependiente. Se evaluaron como variables predictoras, alternativamente, RCC o BCR-ABL1 IS < 1% a los 6 meses, RMM a los 12 meses y RMM a los 24 meses. El modelo incluyó como variables de ajuste: edad, sexo, tratamiento previo con interferón y sokal. Las funciones de SG y SLF se estimaron con el método de Kaplan-Meier y su comparación se evaluó mediante la prueba de log-rank. El modelo de Cox de riesgos proporcionales fue utilizado para analizar los factores de riesgo de falla. Se determinó un nivel alfa de 0.05 para todas las pruebas de significación.
Resultados
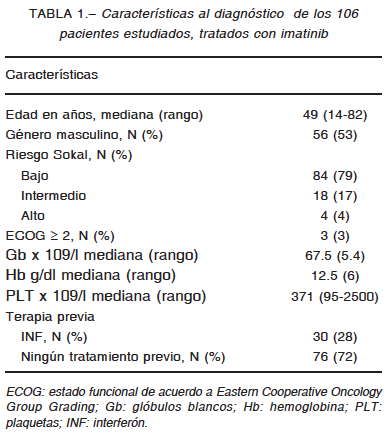
Las características de los pacientes se presentan en la Tabla 1. La estratificación de riesgo evidencia un alto porcentaje de pacientes con Sokal de bajo riesgo en esta población.
La mediana de seguimiento fue 8.9 años IQR (5.8-11.7). Durante este período la probabilidad de SG a 2, 5 y 10 años fue 100%, 97% y 93% respectivamente y la SLF a 2, 5 y 10 años 97%, 90% y 85% respectivamente. La curva de SG tendió a aplanarse luego de los 6 años. Al momento del cierre del análisis 78/106 (74%) pacientes continuaban bajo tratamiento con el imatinib inicial y 21/106 (20%) habían cambiado el tratamiento a otro ITK. La causa de cambio de inhibidor fue falla en el tratamiento en 13 pacientes y toxicidad en los restantes, manifestada por diarrea y edema periférico Grado 3 según Criterios RESPUESTA A IMATINIB EN LEUCEMIA MIELOIDE CRÓNICA 163
Comunes de Terminología para Eventos Adversos12. Durante el periodo de observación se documentaron 5 muertes, 3 casos por causas relacionadas a LMC (evolución a crisis blástica) y los 2 restantes fueron no relacionados (cáncer de colon, neumonía), cinco pacientes se perdieron durante el seguimiento sin causa conocida. Durante el monitoreo, un total de 84% de los pacientes alcanzó el objetivo de obtener RCC o BCR-ABL1 IS < 1% a los 6 meses y 38% alcanzó la RMM a los 12 meses. Al considerar el seguimiento completo, 88% de los pacientes lograron alcanzar RMM y 74% RM 4.0 con una mediana de tiempo a la respuesta de 2.6 años IQR (1.3- 4.6) y 3.6 años IQR (2.3-5.5) respectivamente.
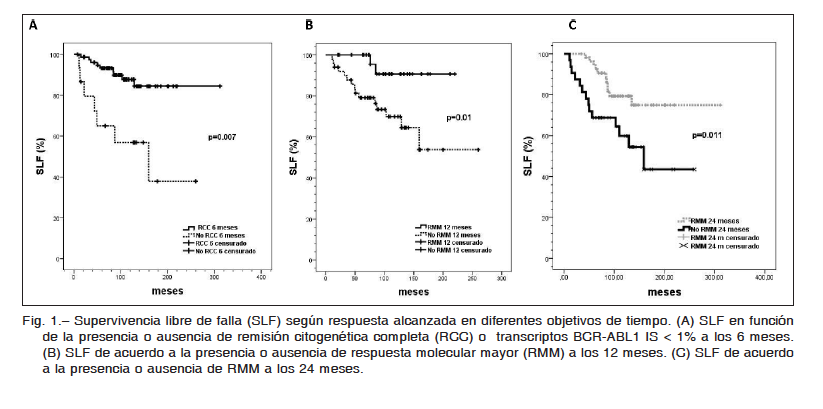
Considerando los objetivos del monitoreo según recomendaciones de ELN, se observa que para quienes alcanzan RCC a 6 meses, la SLF a 10 años es mayor que para aquellos que no la alcanzan (87% vs. 56%, p = 0.007) (Fig. 1A). Con el objetivo de RMM, se observa que para aquellos que alcanzan RMM a los 12 meses la SLF a 10 años es mayor que para los que no la alcanzan (90 vs. 69%, p = 0.01) (Fig. 1B). Esto evidencia un impacto pronóstico positivo de la reducción de BCR-ABL1 tanto a los 6 como a los 12 meses. A su vez, si bien la respuesta a 24 meses no es un objetivo fijado por las guías internacionales de monitoreo, en nuestra cohorte la estimación de SLF a 10 años fue mayor en pacientes con RMM a los 24 meses que en los que no la alcanzan en este período de tiempo (90 vs. 67%, p = 0.001) (Fig. 1C).
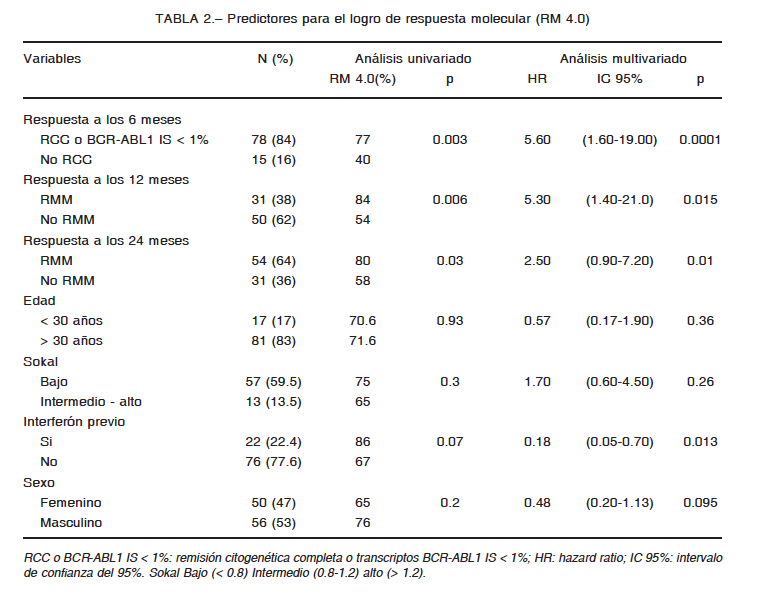
En el análisis multivariado tanto la adquisición de la meta de RCC a los 6 meses como RMM a los 12 meses se asociaron de forma independiente al logro de respuesta profunda RM 4.0 en esta cohorte y confirma su conocido valor para predecir buena respuesta al tratamiento a largo plazo (Tabla 2). Concordantemente, la adquisición de RMM más tardíamente a lo recomendado (24 meses) no se asoció al logro de RM 4.0. Otros potenciales factores pronósticos clínicos analizados (género, edad, puntuación de riesgo Sokal y tratamiento previo con interferón) no mostraron asociación con RM 4.0.
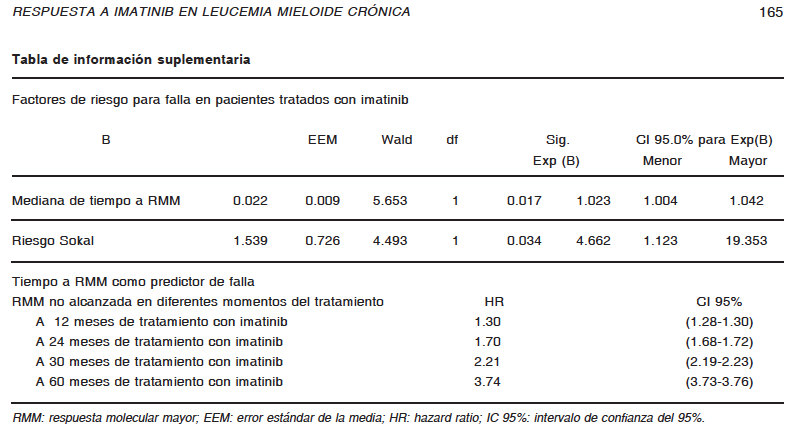
Como objetivo secundario del presente trabajo, se buscó determinar factores de riesgo para fracaso en el tratamiento con imatinib. Utilizando el modelo de Cox de riesgos proporcionales, el tiempo transcurrido hasta lograr RMM [HR: 1.02 (1.00-1.04), p = 0.017] y puntuación de riesgo Sokal intermedio o alto; [HR: 4.66 (1.12-19.35), p = 0.03] fueron predictores independientes de falla en los pacientes tratados con imatinib. Debido a que el tiempo para obtener RMM es una variable continua, el HR asociado a ésta, es equivalente a un incremento mensual del 2% en el riesgo de falla. Interesantemente, el riesgo de falla aumenta con cada año de no haber obtenido RMM, luego de 24 meses muestra un HR de 1.70 (1.68-1.72), luego de 30 meses uno de 2.21 (2.19- 2.23) y luego de 60 meses uno de 3.74 (3.73-3.76) (Ver Tabla de información suplementaria).
Discusión
No hay un consenso claro respecto a la elección de la terapia de primera línea en la LMC. Aunque el imatinib sigue siendo la primera línea de ITK utilizado en muchos países, aún persiste la controversia sobre el mejor agente para los pacientes con reciente diagnóstico. Mientras que los ITK de 2a generación han demostrado respuestas más rápidas13, una clara ventaja de supervivencia sobre el imatinib no ha sido demostrada aún14 y hay evidencia creciente de que los ITK de 2a y 3a generación están asociados a eventos adversos más graves15. El imatinib genérico ya está disponible en varios países con un costo económico menor que el del original. Los resultados a largo plazo con imatinib original podrían ser de interés en este contexto. En esta cohorte, el imatinib ha demostrado altas tasas de respuesta y supervivencia durante un extenso período de estudio. Estos datos proporcionan información en pacientes con LMC fuera de un estudio patrocinado. Una posible debilidad del trabajo fue utilizar el factor de corrección para normalizar todos los resultados de acuerdo con IS. Sin embargo, creemos que esto tiene poco efecto sobre los resultados ya que sólo 6 pacientes tenían nivel de transcriptos BCR-ABL1 IS entre 1-10% a los 6 meses y 3 pacientes a los 12 meses.
Presentamos una cohorte seguida por 9 años con SG y SLF estimadas a 10 años de 93% y 85%, respectivamente. Publicaciones recientes comunican datos de SG y SLF a 10 años del 84% y 82% respectivamente16 y con un seguimiento de 6.3 años, SG y SLF a 6 años del 89% y 87% respectivamente17, siendo nuestros resultados similares en cuanto a supervivencia global y libre de falla. Un punto a destacar es que a pesar de que los pacientes incluidos en el presente trabajo no fueron preseleccionados, una proporción importante de nuestra cohorte tenía buen estado funcional y riesgo Sokal bajo, los que pueden en parte haber influido en los buenos resultados demostrados.
Otro criterio de valoración importante en el tratamiento de la LMC es el logro de respuesta molecular profunda debido a su impacto en la probabilidad de supervivencia16 y también como requisito indispensable para alcanzar la remisión libre de tratamiento4. En nuestro estudio, el 74% de los pacientes alcanzó RM 4.0 y todos estos pacientes continúan en tratamiento con el imatinib inicial. La adquisición de RCC o BCR-ABL1 IS < 1% dentro de los 6 meses y RMM dentro de los 12 meses predice RM profunda y confirma observaciones previas18, 19. Si bien la respuesta molecular a los 3 meses no fue evaluada en este estudio, un estudio reciente basado en la respuesta citogenética llegó a la conclusión de que a pesar de que el nivel de transcriptos medido a los 3 meses ha demostrado un valor predictivo importante, la evaluación de la respuesta a los 6 meses puede proporcionar un mejor predictor del resultado a largo plazo, especialmente para discriminar a los pacientes destinados a tener una mala evolución20. Esto fue confirmado en un estudio posterior que evaluó la importancia pronóstica de la evaluación tanto de las respuestas moleculares a 3 y 6 meses para los pacientes con LMC en fase crónica21. Nuestros resultados son concordantes con la literatura publicada y confirman que la RCC o BCR-ABL1 IS < 1% dentro de los 6 meses es un predictor significativo e independiente para alcanzar respuestas profundas RM 4.0 y mejores probabilidades en términos de supervivencia libre de falla a largo plazo.
Varios estudios demostraron que la adquisición temprana de RMM predice respuestas moleculares profundas y esto fue confirmado en nuestro trabajo; mientras que no se encontró asociación con RM 4.0 para los pacientes que lograron RMM después de 24 meses, como era esperable14, 15, 22.
La alta puntuación de riesgo Sokal y el tiempo de retraso en alcanzar RMM resultaron ser factores de riesgo independientes para falla en nuestra cohorte. Esto está en consonancia con los resultados de una reciente publicación que afirma que la reducción temprana y rigurosa de BCR-ABL previene la progresión y proporciona una ventaja de supervivencia19.
Las correlaciones entre la respuesta molecular y el pronóstico se utilizan actualmente en el monitoreo molecular clínico. La RMM a los 12 meses se ha asociado con mejorías en la supervivencia libre de progresión y la SG en múltiples ensayos22, 23. De acuerdo con las recomendaciones de National Comprehensive Cancer Network, la ausencia de RMM en presencia de RCC no se considera falla24. La ELN considera RMM a los 12 meses como óptima y entre el 0.1% y el 1.0% alerta, lo que implica que el logro de respuesta citogenética completa sin RMM no constituye una respuesta óptima; pero no alcanzar RMM no es un criterio de falla en ningún momento. Se desarrolló un modelo para esta cohorte en el que el tiempo para alcanzar RMM resultó un factor de riesgo para falla al tratamiento. El riesgo aumenta por cada año de incumplimiento en alcanzar la meta de RMM y en esta situación es recomendado un cambio en el tratamiento. Nuestros hallazgos son concordantes con un modelo presentado recientemente con datos del estudio CML-IV que define que un punto de tiempo óptimo para predecir la SLP en los pacientes con RMM es a los 2.25 años después del diagnóstico25. En ese estudio los pacientes con RMM tienen menor riesgo de progresión que los pacientes que no alcanzan RMM en cualquier otro punto del tiempo.
En conclusión, este estudio de un largo período de seguimiento en el tratamiento con imatinib evidencia que se logran altas tasas de respuesta y supervivencia prolongada. Se confirma la conocida importancia de alcanzar respuestas citogéneticas y moleculares en forma temprana, acorde a las guías internacionales, así como los buenos resultados asociados al logro de respuestas moleculares profundas con muy pocos eventos de transformación a crisis blástica o fase acelerada. Si bien con imatinib se obtienen muy buenos resultados, en algunos pacientes aún progresa la enfermedad. La identificación de factores pronósticos asociados con un mayor riesgo de mala respuesta puede ayudar a identificar a aquellos pacientes que presentarán falla al tratamiento con el fin de considerar un cambio de tratamiento a otro inhibidor en un tiempo conveniente. Este estudio refuerza la importancia de la vigilancia molecular bajo estandarización internacional en los momentos conocidos y recomendados. La educación sobre el monitoreo molecular temprano debe seguir siendo un objetivo en nuestro país.
Agradecimientos: Los autores desean agradecer a las enfermeras y técnicos de laboratorio por sus contribuciones. A Graciela Enrico por la corrección del manuscrito.
Conflicto de intereses: Carolina Pavlovsky es oradora para Novartis y Bristol-Myers Squibb y es miembro del Consejo Asesor de Novartis. Miguel A. Pavlovsky es un orador y miembro del Consejo Asesor de Novartis y Janssen.
Bibliografía
-
Kantarjian H, O’Brien S, Jabbour E, et al. Improved survival in chronic myeloid leukemia since the introduction of imatinib therapy: a single-institution historical experience. Blood 2012; 119: 1981-7.
2. Baccarani M, Deininger MW, Rosti G, et al. ELN recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122: 872-83.
3. Pavlovsky C, Giere I, Moiraghi B, et al. Molecular monitoring to imatinib in chronic myeloid leukemia patients in complete cytogenetic remission: Does achievement of a stable major molecular response (MMR) at any timepoint identify a privileged group of patients? A multicenter experience in Argentina and Uruguay. Clin Lymphoma Myeloma Leuk 2011; 11: 280-5.
4. Mahon FX, Réa D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010; 11: 1029-35.
5. Baccarani M, Cortés J, Pane F, et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol 2009; 27: 6041-51.
6. Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in ‘good-risk’ chronic granulocytic leukemia. Blood 1984; 63: 789-99.
7. Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-55.
8. Lauseker M, Hanfstein B, Haferlach C, et al. Equivalence of BCR-ABL transcript levels with complete cytogenetic remission in patients with chronic myeloid leukemia in chronic phase. J Cancer Res Clin Oncol 2014; 140: 1965-9.
9. Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of ‘real-time’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia – a Europe Against Cancer program. Leukemia 2003; 17: 2318-57.
10. Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood 2006; 108: 28-37.
11. Cross NC, White HE, Colomer D, et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leukemia 2015; 29: 999-1003.
12. Common Terminology Criteria for Adverse Events (CTCAE) v4.0. En: https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf; consultado el 18/8/2016.
13. Hjorth-Hansen H, Stenke L, Soderlund S, et al. Dasatinib induces fast and deep responses in newly diagnosed chronic myeloid leukaemia patients in chronic phase: clinical results from a randomised phase-2 study (NordCML006). Eur J Haematol 2015; 94: 243-50.
14. Jain P, Kantarjian H, Alattar ML, et al. Long-term molecular and cytogenetic response and survival outcomes with imatinib 400 mg, imatinib 800 mg, dasatinib, and nilotinib in patients with chronic-phase Chronic Myeloid Leukaemia: retrospective analysis of patient data from five clinical trials. Lancet Haematol 2015; 3: 118-28.
15. Lang AS, Mounier M, Roques M, Chretien ML, Boulin M. A retrospective study of the prescribing and outcomes of tyrosine kinase inhibitors in Chronic Myeloid Leukemia over a period of more than 10 years. J Clin Pharm Ther 2015; 4: 391-7.
16. Kalmanti L, Saussele S, Lauseker M, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML-study IV. Leukemia 2015; 5: 1123-32.
17. Castagnetti F, Gugliotta G, Breccia M, et al. Long-term outcome of chronic myeloid leukemia patients treated frontline with imatinib. Leukemia 2015; 9: 1823-31.
18. Hughes TP, Hochhaus A, Branford S, et al. Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571 (IRIS). Blood 2010; 19: 3758-65.
19. Hehlmann R, Müller MC, Lauseker M, et al. Deep molecular response is reached by the majority of patients treated with imatinib, predicts survival, and is achieved more quickly by optimized high-dose imatinib: results from the randomized CML-study IV. J Clin Oncol 2014; 32: 415-23.
20. Nazha A, Kantarjian H, Jain P, et al. Assessment at 6 months may be warranted for patients with chronic myeloid leukemia with no major cytogenetic response at 3 months. Haematologica 2013; 98: 1686-8.
21. Branford S, Roberts N, Yeung DT, Altamura H, Parker WT, Hughes TH. Any BCR-ABL reduction below 10% at 6 months of therapy significantly improves outcome for CML patients with a poor response at 3 months. ASH annual meeting 2013; session 632: abstract 254. En: http://www.bloodjournal.org/content/122/21/254; consultado el 11/11/2016.
22. Hughes TP, Hochhaus A, Branford S, et al. Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349: 1423-32.
23. Hehlmann R, Lauseker M, Jung-Munkwitz S, et al. Tolerability-adapted imatinib 800 mg/d versus 400 mg/d versus 400 mg/d plus interferon-α in newly diagnosed chronic myeloid leukemia. J Clin Oncol 2011; 29: 1634-42.
24. O’Brien S, Radich JP, Abboud CN, et al. Chronic myelogenous leukemia, version 1.2015. J Natl Compr Canc Netw 2014; 12: 1590-610.
25. Saussele S, Hehlmann R, Dietz C, et al. Defining therapy goals for major molecular remission in chronic myeloid leukemia: results of the randomized CML-study IV. ASH Annual Meeting 2014; session 632: abstract 155. En: http://www.bloodjournal.org/content/124/21/155; consultado el 11/11/2016.