Esta nota intenta destacar cuanto importa una autopsia para determinar “el sitio y las causas de las enfermedades”1.
En marzo del año 2016, un artículo en el American Journal of Pathology, comunica los resultados de una autopsia, la primera de un caso fatal del Síndrome respiratorio del Medio Oriente por infección de virus Corona (Middle East Respiratory Syndrome Coronavirus, MERS-CoV)2. El artículo recibe en el mismo número de la revista un entusiasta comentario, tres páginas con 19 referencias bibliográficas, que insiste en el valor de la tan devaluada e imprescindible autopsia3.
El primer caso comunicado de MERS-CoV ocurrió en 2012, en Arabia Saudita, y la OMS (WHO) informa que desde 2012 al 31 de octubre del 2016 el número de casos de MERS-CoV confirmados por laboratorio era 1826 y los fatales 649 (mortalidad ~36%). Las evidencias indican que la infección afecta a los camellos dromedarios, estos la trasmiten a los humanos y, está probado, que éstos a otros humanos4, 5. Arabia Saudita es el país más afectado y sitio del último brote, pero no faltan casos en el Reino Unido, Alemania, EE.UU., Austria, Holanda, Corea, países con pocos camellos, pero con muchos humanos viajeros5.
El agente causal está identificado, es un virus trasmitido de los animales al hombre, se cree que se originó en los murciélagos y pasó a los camellos en un tiempo lejano. Pero persisten preguntas sin respuesta en la epidemiología; no están claras ni las vías de transmisión de los animales a los humanos y entre los humanos, ni la prevención, ni el tratamiento específico6.
Hasta la autopsia que comentamos no se conocían las lesiones tisulares en los humanos fallecidos; razones culturales o religiosas no facilitaban las autopsias. Se conocían las lesiones en los animales de experimentación infectados y los resultados no siempre concordaban entre unas especies y otras. Por ejemplo, el receptor celular del huésped para MERS-CoV es la dipeptidil peptidasa-4 (DPP4), proteína ubicada en la membrana celular, que varía según las especies y algunas no son susceptibles3.
Resumimos el cuadro clínico y los resultados de la autopsia que se realizó en Abu Dahbi (Emiratos Árabes): Hombre de 45 años, filipino, paramédico, sin contacto con enfermos, cuya enfermedad se desarrolló en diez días, con fiebre, tos, dificultad respiratoria progresiva, opacidades en las radiografías de tórax, hipotensión, insuficiencia renal y muerte pese al tratamiento. El hisopado nasofaríngeo hecho al ingreso fue positivo para MERS-CoV con la técnica RP-PCR, para los genes blanco UpE y ORF1a. El cadáver se mantuvo refrigerado a 4° C por diez días antes de la autopsia. Se encontraron derrames pleural, pericárdico y peritoneal, pulmones condensados y edematosos y congestión generalizada. Los exámenes histológicos e inmuno-histoquímicos mostraron en los pulmones patrón de daño alveolar difuso en fase exudativa; no se encontraron inclusiones virales y los anticuerpos contra los antígenos de MERS-CoV se localizaron en neumonocitos y células epiteliales sinciciales (fusión de neumonocitos) y en células de glándulas submucosas íntegras y necróticas. La microscopía electrónica mostró partículas virales en neumonocitos infectados y con cambios degenerativos. No se encontraron antígenos de MERS-CoV en riñones, ganglios linfáticos, bazo, médula ósea, intestino delgado y colon. Las lesiones histológicas encontradas en otros órganos son irrelevantes a lo esencial. La secuencia genómica del virus fue similar a otros casos y relacionada con cepas derivadas de camellos dromedarios, aunque el enfermo no tuvo contacto con camellos.
En suma, los sitios del efecto citopático del virus son los neumonocitos individuales o fusionados (sincicio) y las células de las glándulas mucosas, la localización es en parches, no difusa. Las evidencias de infección viral se encontraron solo en los pulmones, ninguna extra-pulmonar, pese a que el receptor del virus, la proteína DPP4, se encuentra en muchos tejidos no se encontró otra; la insuficiencia renal, común en los casos graves y fatales, no está causada por infección viral, otras deben ser las causas. Una autopsia no responde a todas las preguntas, plantea otras.
Esta única autopsia no es una autopsia convencional, era un caso clave y para producir la información que faltaba se necesitaron 16 autores y varias instituciones locales y de EE.UU. Pero aun una autopsia convencional puede, por ejemplo, diferenciar entre una encefalitis post-vacunal y una rabia debida a una vacuna insuficientemente atenuada o ineficaz, diagnosticar una o varias infecciones oportunistas, poner en evidencia el riesgo de lesiones cerebrales en los boxeadores, aun de pesos muy livianos, y en los jugadores de fútbol americano, descubrir una nueva enfermedad, o descubrir en una “vieja” autopsia que una “nueva” enfermedad no es tan nueva.
Es cierto que este síndrome es exótico para estas latitudes, los pocos camellos están en los zoológicos o circos y los viajeros al y del Medio Oriente son pocos, por ahora. Tampoco es probable que la epidemia se transforme en pandemia. Esta nota es un recordatorio del valor de siquiera una autopsia, no un ejercicio de exotismo. El párrafo final del comentario de David H. Walker en el American Journal of Pathology insiste sobre este valor, en especial en la patología de otras enfermedades emergentes, e incluye una frase que traducimos: “Porque es la comunicación de solo una autopsia de una nueva enfermedad que ha matado más de 500 individuos en los últimos tres años, debería despertar nuestra atención sobre el valor de un procedimiento final en la búsqueda de nuevos conocimientos médicos. […]”3.
Juan Antonio Barcat
e-mail: jabarcat@yahoo.com.ar
1. Barcat JA. Autopsias: Los comienzos antes del fin. Medicina (B Aires) 2016; 76: 187-9.
2. Ng DL, Al Hosani F, Keating MK, et al. Clinicopathologic, immunohistochemical, and ultrastructural findings of a fatal case of Middle East respiratory syndrome coronavirus infection in the United Arab Emirates, April 2014. Am J Pathol 2016; 186: 652-8.
3. Walker DH. Value of autopsy emphasized in the case report of a single patient with Middle East respiratory syndrome. Am J Pathol 2016; 186: 507-10.
4. WHO. Middle East respiratory syndrome coronavirus (MERS-CoV). Fact sheet. June 2015. En: http://www.who.int/mediacentre/factsheets/mers-cov/en/; consultado el 29/11/2016.
5. WHO. Confirmed cases of Middle East respiratory syndrome coronavirus (MERS-CoV). 2012-2016. En: http://www.who.int/csr/disease/coronavirus_infections/maps-epicurves/en; consultado el 29/1/2016.
6. Zumla A, Hui DS, Perlman S. Middle East respiratory syndrome. Lancet 2015; 386: 995-1007.
Bibliografía
-
Bibliografía
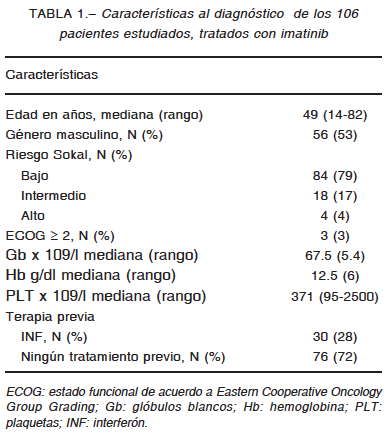
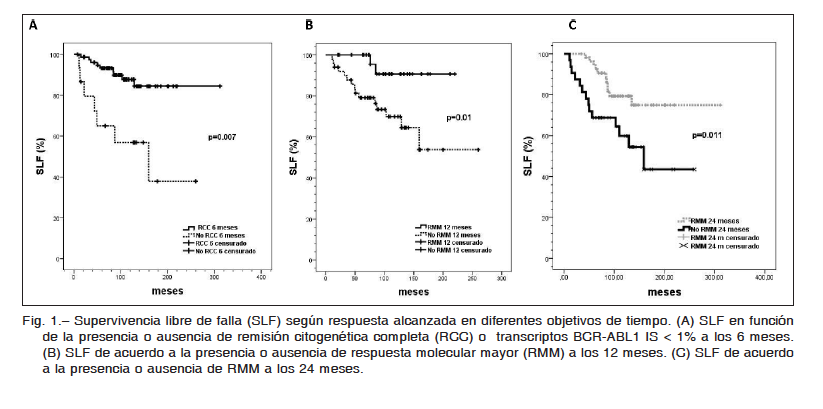
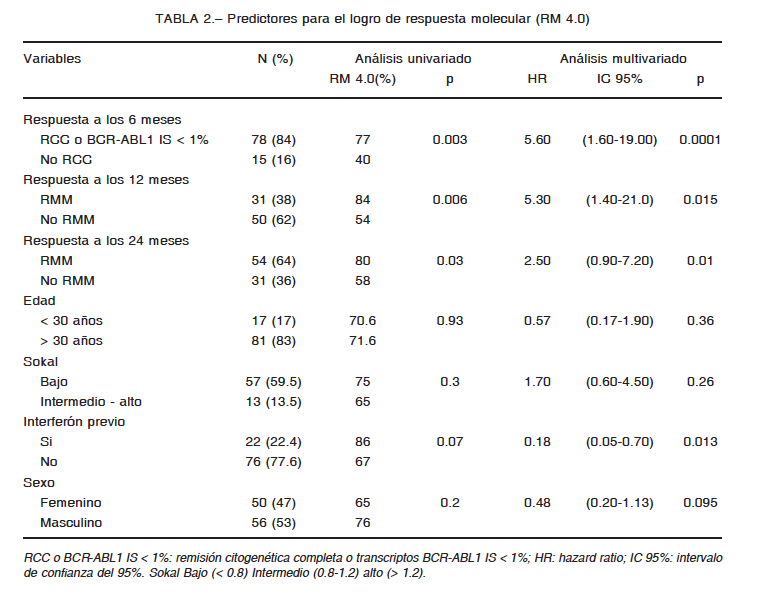
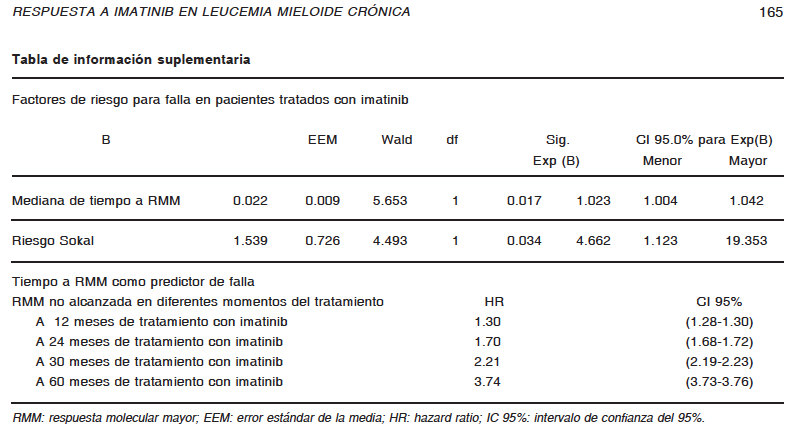
1. Kantarjian H, O’Brien S, Jabbour E, et al. Improved survival in chronic myeloid leukemia since the introduction of imatinib therapy: a single-institution historical experience. Blood 2012; 119: 1981-7.
2. Baccarani M, Deininger MW, Rosti G, et al. ELN recommendations for the management of chronic myeloid leukemia: 2013. Blood 2013; 122: 872-83.
3. Pavlovsky C, Giere I, Moiraghi B, et al. Molecular monitoring to imatinib in chronic myeloid leukemia patients in complete cytogenetic remission: Does achievement of a stable major molecular response (MMR) at any timepoint identify a privileged group of patients? A multicenter experience in Argentina and Uruguay. Clin Lymphoma Myeloma Leuk 2011; 11: 280-5.
4. Mahon FX, Réa D, Guilhot J, et al. Discontinuation of imatinib in patients with chronic myeloid leukaemia who have maintained complete molecular remission for at least 2 years: the prospective, multicentre Stop Imatinib (STIM) trial. Lancet Oncol 2010; 11: 1029-35.
5. Baccarani M, Cortés J, Pane F, et al. Chronic myeloid leukemia: an update of concepts and management recommendations of European LeukemiaNet. J Clin Oncol 2009; 27: 6041-51.
6. Sokal JE, Cox EB, Baccarani M, et al. Prognostic discrimination in ‘good-risk’ chronic granulocytic leukemia. Blood 1984; 63: 789-99.
7. Oken MM, Creech RH, Tormey DC, et al. Toxicity and response criteria of the Eastern Cooperative Oncology Group. Am J Clin Oncol 1982; 5: 649-55.
8. Lauseker M, Hanfstein B, Haferlach C, et al. Equivalence of BCR-ABL transcript levels with complete cytogenetic remission in patients with chronic myeloid leukemia in chronic phase. J Cancer Res Clin Oncol 2014; 140: 1965-9.
9. Gabert J, Beillard E, van der Velden VH, et al. Standardization and quality control studies of ‘real-time’ quantitative reverse transcriptase polymerase chain reaction of fusion gene transcripts for residual disease detection in leukemia – a Europe Against Cancer program. Leukemia 2003; 17: 2318-57.
10. Hughes T, Deininger M, Hochhaus A, et al. Monitoring CML patients responding to treatment with tyrosine kinase inhibitors: review and recommendations for harmonizing current methodology for detecting BCR-ABL transcripts and kinase domain mutations and for expressing results. Blood 2006; 108: 28-37.
11. Cross NC, White HE, Colomer D, et al. Laboratory recommendations for scoring deep molecular responses following treatment for chronic myeloid leukemia. Leukemia 2015; 29: 999-1003.
12. Common Terminology Criteria for Adverse Events (CTCAE) v4.0. En: https://evs.nci.nih.gov/ftp1/CTCAE/CTCAE_4.03_2010-06-14_QuickReference_5x7.pdf; consultado el 18/8/2016.
13. Hjorth-Hansen H, Stenke L, Soderlund S, et al. Dasatinib induces fast and deep responses in newly diagnosed chronic myeloid leukaemia patients in chronic phase: clinical results from a randomised phase-2 study (NordCML006). Eur J Haematol 2015; 94: 243-50.
14. Jain P, Kantarjian H, Alattar ML, et al. Long-term molecular and cytogenetic response and survival outcomes with imatinib 400 mg, imatinib 800 mg, dasatinib, and nilotinib in patients with chronic-phase Chronic Myeloid Leukaemia: retrospective analysis of patient data from five clinical trials. Lancet Haematol 2015; 3: 118-28.
15. Lang AS, Mounier M, Roques M, Chretien ML, Boulin M. A retrospective study of the prescribing and outcomes of tyrosine kinase inhibitors in Chronic Myeloid Leukemia over a period of more than 10 years. J Clin Pharm Ther 2015; 4: 391-7.
16. Kalmanti L, Saussele S, Lauseker M, et al. Safety and efficacy of imatinib in CML over a period of 10 years: data from the randomized CML-study IV. Leukemia 2015; 5: 1123-32.
17. Castagnetti F, Gugliotta G, Breccia M, et al. Long-term outcome of chronic myeloid leukemia patients treated frontline with imatinib. Leukemia 2015; 9: 1823-31.
18. Hughes TP, Hochhaus A, Branford S, et al. Long-term prognostic significance of early molecular response to imatinib in newly diagnosed chronic myeloid leukemia: an analysis from the International Randomized Study of Interferon and STI571 (IRIS). Blood 2010; 19: 3758-65.
19. Hehlmann R, Müller MC, Lauseker M, et al. Deep molecular response is reached by the majority of patients treated with imatinib, predicts survival, and is achieved more quickly by optimized high-dose imatinib: results from the randomized CML-study IV. J Clin Oncol 2014; 32: 415-23.
20. Nazha A, Kantarjian H, Jain P, et al. Assessment at 6 months may be warranted for patients with chronic myeloid leukemia with no major cytogenetic response at 3 months. Haematologica 2013; 98: 1686-8.
21. Branford S, Roberts N, Yeung DT, Altamura H, Parker WT, Hughes TH. Any BCR-ABL reduction below 10% at 6 months of therapy significantly improves outcome for CML patients with a poor response at 3 months. ASH annual meeting 2013; session 632: abstract 254. En: http://www.bloodjournal.org/content/122/21/254; consultado el 11/11/2016.
22. Hughes TP, Hochhaus A, Branford S, et al. Frequency of major molecular responses to imatinib or interferon alfa plus cytarabine in newly diagnosed chronic myeloid leukemia. N Engl J Med 2003; 349: 1423-32.
23. Hehlmann R, Lauseker M, Jung-Munkwitz S, et al. Tolerability-adapted imatinib 800 mg/d versus 400 mg/d versus 400 mg/d plus interferon-α in newly diagnosed chronic myeloid leukemia. J Clin Oncol 2011; 29: 1634-42.
24. O’Brien S, Radich JP, Abboud CN, et al. Chronic myelogenous leukemia, version 1.2015. J Natl Compr Canc Netw 2014; 12: 1590-610.
25. Saussele S, Hehlmann R, Dietz C, et al. Defining therapy goals for major molecular remission in chronic myeloid leukemia: results of the randomized CML-study IV. ASH Annual Meeting 2014; session 632: abstract 155. En: http://www.bloodjournal.org/content/124/21/155; consultado el 11/11/2016.