FABIANA PRADO, JUAN PABLO DOS RAMOS, NEBIL LARRAÑAGA, GERMÁN ESPIL, SHIGERU KOZIMA
Servicio de Diagnóstico por Imágenes, Hospital de Agudos Dr. Cosme Argerich, Buenos Aires, Argentina
Resumen El tumor fibroso solitario es raro. Si bien su localización más frecuente es la pleura, han sido
informados algunos casos de ubicación retroperitoneal. Es difícil diferenciarlo imagenológicamente de otras neoplasias, por lo que casi siempre el diagnóstico es histológico. Dado que los tumores fibrosos solitarios tienen presentaciones clínicas muy diversas, una mejor compresión de la ubicación y sus características imagenológicas ayudaría a abreviar la lista de diagnósticos diferenciales. Comunicamos un tumor fibroso solitario de localización retroperitoneal cuyo diagnóstico fue confirmado por examen histológico.
Palabras clave: tumor fibroso solitario, retroperitoneo, hipoglucemia
Abstract Solitary fibrous tumor and Doege-Potter syndrome. The solitary fibrous tumor is uncommon. Even
though it frequently locates in the pleura, a few cases have been reported in the retroperitoneum. Differentiation from other neoplasms is difficult, and therefore the diagnosis is always attained through histological examination. Although solitary fibrous tumors have variable clinical behaviors, a better comprehension of the location and its imaging characteristics would help to decrease the list of differential diagnoses. We report a solitary fibrous tumor located in the retroperitoneum whose diagnosis was confirmed by histological examination.
Key words: solitary fibrous tumor, retroperitoneum, hypoglucemia
Recibido: 7-VI-2017 Aceptado: 1-IX-2017
Dirección postal: Fabiana Prado, Av. Juan Bautista Alberdi 984 7° B, 1424 Buenos Aires, Argentina
e-mail: fabilu@hotmail.com
El tumor fibroso solitario es una neoplasia mesenquimal rara, originada en fibroblastos y miofibroblastos. La localización más frecuente es pleural, pero puede aparecer en cualquier lugar del cuerpo, incluyendo tejidos blandos y vísceras. Presentamos un caso de localización retroperitoneal, la que es poco frecuente y de diagnóstico difícil, ya que suele simular otras neoplasias.
Caso clínico
Varón de 68 años sin antecedentes clínicos de relevancia que presentó dolor abdominal difuso de larga data y escalofríos. Al examen físico se constató diaforesis y abdomen globuloso. Laboratorio: glóbulos blancos 17 000, eritrosedimentación 25 mm/h), glucemia 39 mg/dl.
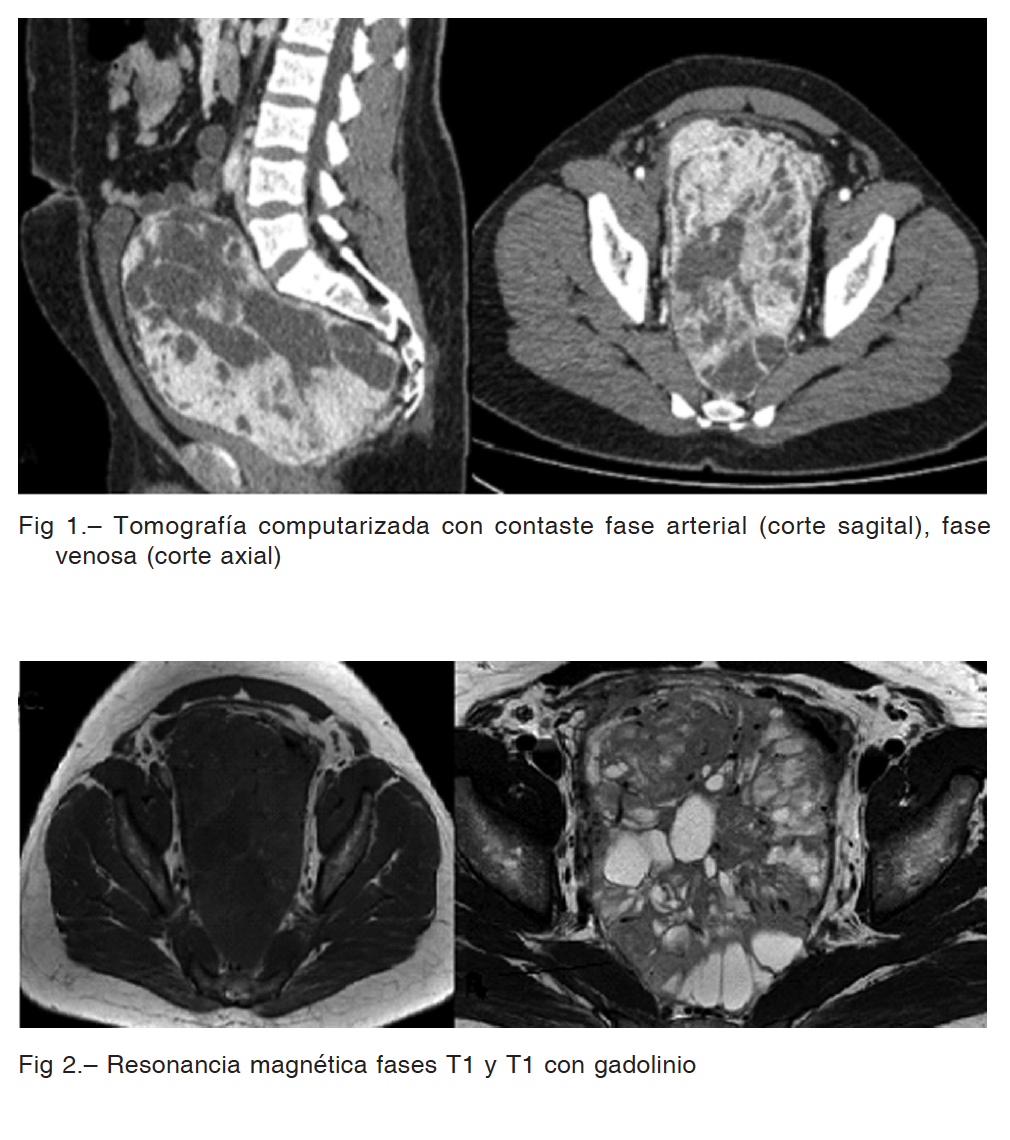
En la tomografía computarizada con contraste endovenoso se observó voluminosa formación centro pélvica, de contornos definidos, heterogénea con densidad de partes blandas y áreas más hipodensas en su interior (Fig. 1). La misma realzaba ávidamente tras la administración de contraste endovenoso (en tomografía computarizada y resonancia magnética) a predominio periférico, y lavaba paulatinamente en fases tardías. La resonancia magnética mostró la formación hipointensa en T1, hiperintensa en T2 con áreas de menor intensidad y espacios con vacío de flujo (Fig. 2).
El diagnóstico de tumor fibroso solitario de origen retroperitoneal fue confirmado histológicamente tras la exéresis total del tumor.
El paciente evolucionó en el post operatorio sin incidentes y no volvió a presentar episodios de hipoglucemia. Fue dado de alta al décimo segundo día postoperatorio.
Discusión
Inicialmente, estos tumores fueron considerados como derivados de células mesoteliales o submesoteliales de pleura, pericardio y peritoneo, por lo que recibieron diversos nombres como tumores fibrosos localizados, mesoteliomas fibrosos localizados, fibromas subserosos y fibromas submesoteliales1. Sin embargo, gracias al advenimiento de la inmunohistoquímica, logró demostrarse su origen en fibroblastos o miofibroblastos, explicando así aquellos tumores que fueron descritos en sitios extratorácicos, desprovistos de células mesoteliales. En la actualidad, la Organizacion Mundial de la Salud los categoriza como tumores de partes blandas, de potencial intermedio y con bajo riesgo de metástasis, junto al hemangioperocitoma2, con el que comparten características clínicas, imagenológicas y citopatológicas3.
Han sido descriptos en varias localizaciones: cabeza, cuello (ej. meninges, órbita, sistema respiratorio, glándulas
salivales, tiroides), abdomen y pelvis (hígado, páncreas, tracto gastrointestinal, peritoneo, retroperitoneo, vejiga, próstata, cordón espermático, genitales femeninos). La localización retroperitoneal es muy infrecuente.
Clínicamente suelen ser asintomáticos; sin embargo, dependiendo de su localización y tamaño pueden dar síntomas por compresión de estructuras adyacentes.
Menos del 5% pueden presentar el síndrome paraneoplásico denominado Doege-Potter con hipoglucemia, debido a que el tumor secreta abundante cantidad de factor de crecimiento insulínico tipo 2 (más común en aquéllos que se presentan en pelvis y retroperitoneo)5. Otros síntomas y signos sistémicos son artralgias, osteoartropatía hipertrófica y deformación de las epífisis óseas en palo de golf6.
La tomografía computarizada es el mejor método no invasivo de estudio. Se visualizan formaciones voluminosas, hipervasculares, bien circunscriptas, que desplazan o comprimen los órganos adyacentes. Puede presentar áreas hipointensas que no realzan tras la administración de contraste, y que constituyen áreas de necrosis o degeneración quística. Pueden presentarse calcificaciones amorfas. Otra característica es que dependiendo de la celularidad del tumor, el realce que persiste en fase venosa y tardía se correlaciona con áreas de hipercelularidad. Por otra parte, si se observa un realce tenue en fase arterial que aumenta en fases tardías estaría en relación a presencia de estroma fibroso o colágeno.
En resonancia magnética, los tumores fibrosos solitarios suelen tener una intensidad de señal intermedia en las imágenes ponderadas en T1 y baja intensidad de señal heterogénea con vacíos de flujo en las imágenes ponderadas en T2, posterior a la administración de contraste de gadolinio se observa un comportamiento similar al de la tomografía computarizada.
La angiografía evidencia tumores altamente vasculares, de distribución arboriforme, con un marcado aumento del calibre tanto de las arterias como de las venas, en las que puede identificarse un pedículo vascular7. Dada la alta vascularización del tumor fibroso solitario, la embolización preoperatoria es útil para reducir la pérdida sanguínea intraoperatoria4.
A pesar de que en su mayoría son benignos, el comportamiento es imprevisible. Entre el 15 y el 20% de los tumores fibrosos solitarios son agresivos, y eventualmente recurrentes. Aquellos malignos son típicamente grandes, demuestran atipia celular y áreas más frecuentes de necrosis y hemorragia, aunque estas características no son patognomónicas. Se ha descrito que los localizados en mediastino, abdomen, retroperitoneo y pelvis suelen tener un comportamiento más agresivo que los ubicados en las extremidades8.
En retroperitoneo, el diagnóstico diferencial incluye otras neoplasias como los tumores desmoides, leiomiosarcoma, tumores estromales gastrointestinales, mesotelioma maligno, sarcoma sinovial, o tumores neurogénicos.
Dada la rareza del tumor fibroso solitario y la similitud con otras neoplasias, el diagnóstico es histopatológico.
La escisión quirúrgica es el tratamiento de elección, con una tasa de supervivencia del 100% en 5 años si se logró la exéresis total. Suelen presentar metástasis a distancia (hueso, pulmón, hígado) y se ha descrito un 20% de riesgo de recidiva. El uso de quimioterapia está reservado para los tumores fibrosos solitarios que se asocian a metástasis o para pacientes sintomáticos cuyo tumor no es resecable.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Langman G. Solitary fibrous tumor: A pathological enigma and clinical dilemma. J Thorac Dis 2011; 3: 86-7.
2. Fletcher CD. The evolving classification of soft tissue tumours: an update based on the new WHO classification. Histopathology 2006; 48: 3-12.
3. Jo VY, Fletcher CD. WHO classification of soft tissue tumours: an update based on the 2013 (4th) edition. Pathology 2014; 46: 95-104.
4. Shanbhogue AK, Prasad SR, Takahashi N, Vikram R, Zaheer A, Sandrasegaran K. Somatic and visceral solitary fibrous tumors in the abdomen and pelvis: cross-sectional imaging spectrum. Radiographics 2011; 31: 293-408.
5. Morimitsu Y, Nakajima M, Hisaoka M, Hashimoto H. Extrapleural solitary fibrous tumor: clinicopathologic study of 17 cases and molecular analysis of the p53 pathway. APMIS 2000; 108: 617-25.
6. Fridlington J, Weaver J, Kelly B, Kelly E. Secondary hypertrophic osteoarthropathy associated with solitary fibrous tumor of the lung. J Am Acad Dermatol 2007; 57 (5 Suppl): S106-10.
7. Goldman SM, Davidson AJ, Neal J. Retroperitoneal and pelvic hemangiopericytomas: clinical, radiologic, and pathologic correlation. Radiology 1988; 168: 13-7.
8. Hasegawa T, Matsuno Y, Shimoda T, Hasegawa F, Sano T, Hirohashi S. Extrathoracic solitary fibrous tumors: their histological variability and potentially aggressive behavior. Hum Pathol 1999; 30: 1464-73.
9. Bruzzone A, Varaldo M, Ferrarazzo C, Tunessi G, Mencoboni M . Solitary fibrous tumor. Rare Tumors 2010; 2: e-64.
– – – –
The intellect is such a pliable and various weapon that man, provided with it, is practically bereft of all others, but it is a weapon of no great efficacy against instinct.
El intelecto es un arma tan maleable y variada que el hombre, con él provisto, queda prácticamente despojado de todas las demás, pero es un arma de no mucha eficacia contra el instinto.
William Somerset Maugham (1874-1965)
A Writer’s Notebook (1949), Harmondsworth, Middlesex (UK): Penguin, 1967, p 29
