SOLEDAD SOSA1, KARINA DANILOWICZ1, SANTIAGO GONZÁLEZ ABBATI2 GUSTAVO SEVLEVER3
1División Endocrinología, Hospital de Clínicas José de San Martín-UBA,2Servicio de Neurocirugía,
Hospital de Clínicas José de San Martín-UBA, 3Departamento de Neuropatología, Fundación para la Lucha
contra las Enfermedades Neurológicas de la Infancia (FLENI), Buenos Aires, Argentina
Resumen El oncocitoma fusocelular es una neoplasia selar primaria no endocrina infrecuente, de curso clí-
nico benigno. Debido a su similitud morfológica con los adenomas hipofisarios, considerar al oncocitoma como diagnóstico diferencial lleva a un abordaje quirúrgico cuidadoso, con el objetivo de evitar el sangrado intraquirúrgico y lograr la resección más completa posible, de la que parecería depender la evolución a largo plazo. Se presenta el caso de un hombre de 60 años que consultó por alteración campimétrica. La evaluación bioquímica evidenció panhipopituitarismo y la resonancia magnética (RM) una lesión selar. Se indicó tratamiento quirúrgico por compromiso visual con diagnóstico presuntivo de macroadenoma hipofisario no funcionante. El diagnóstico anatomopatológico fue compatible con oncocitoma fusocelular. En la RM selar, postquirúrgica (a los 5 meses), se observó remanente tumoral y se decidió realizar radiocirugía, constatándose en las subsiguientes RM disminución tumoral sin evidencia de remanente ni recidiva en 4 años de seguimiento. La comunicación de nuevos casos de esta entidad permitirá aumentar la disponibilidad de evidencia y ayudará a determinar la eficacia de los tratamientos disponibles y el pronóstico.
Palabras clave: oncocitoma fusocelular, hipófisis, radiocirugía
Abstract Pituitary spindle cell oncocytoma. Spindle cell oncocytoma is an infrequent benign non-endocrine
sellar neoplasm. Due to its similar morphology to pituitary adenomas, consideration of this differential diagnosis would conduce to a more careful surgical approach in order to avoid intraoperative bleeding and aiming to a complete resection, on which depends long-term outcomes. We present the case of a 60-year-old male who complained about visual abnormalities, with computerized visual field confirmation. On biochemistry, a panhypopituitarism was detected. The brain magnetic resonance images showed a sellar mass. A non-functioning pituitary macroadenoma was presumptively diagnosed and due to the visual impairment, surgical transesphenoidal treatment was indicated. The histological diagnosis was spindle cell oncocytoma. Five months after surgery, the control image demonstrated a lesion that was considered as remnant tumor, hence radiosurgery was performed. During the follow-up, the tumor reduced its size and four years after initial treatment, the sellar resonance imaging showed disappearance of the residual tumor. Communication of new cases of this rare entity will enlarge the existing evidence and will help to determinate the most effective treatment and prognosis.
Key words: spindle cell oncocytoma, hypophysis, radiosurgery
Recibido: 27-III-2017 Aceptado: 18-VIII-2017
Dirección postal Dra. Soledad Sosa, Hospital de Clínicas José de San Martín-UBA, Av. Córdoba 2351, 1120 Buenos Aires, Argentina
e-mail: drasoledadsosa@yahoo.com.ar
El oncocitoma fusocelular (OFC) corresponde a una enfermedad tumoral no endocrina inusual de la región selar. Descripta inicialmente en 2002 por Roncaroli y col.1, fue incluido en la clasificación 2007 de tumores del sistema nervioso central de la Organización Mundial de la Salud (OMS)2 como entidad independiente. La frecuencia reportada oscila entre 0.1-0.8% de los tumores selares3, 4 y se presenta mayoritariamente en adultos de edad media, sin predominio aparente de género3, 5, 6. De etiología incierta, se considera originada a partir de células foliculoestrelladas (CFE) debido a similitudes inmunohistoquímicas y ultraestructurales1, 6-8. Las CFE representan el 5% de la celularidad adenohipofisaria y constituyen una red vinculada a funciones de sostén, comunicación intercelular y regulación de crecimiento/secreción4, 8. Más recientemente, se propuso un origen alternativo a partir de células de sostén neurohipofisarias, basado en la expresión de factor de transcripción tiroideo-1 (TTF-1)9. Si bien presenta curso clínico favorable (grado I)2, se han descripto casos de recidiva local, asociados a resección inicial incompleta4, 5. Hasta 2017 se han comunicado 38 casos.
Caso clínico
Evaluamos el caso de un hombre de 60 años con antecedente de déficit visual izquierdo, debido a un desprendimiento retiniano traumático 12 años previos a la consulta. Consultó desde 4 años atrás por alteraciones campimétricas en ojo derecho, en la última oportunidad con 4 meses de evolución. Refirió además astenia, disminución de la libido y ausencia de erecciones matinales de 8 meses de evolución. Se constató hemianopsia bitemporal por confrontación y disminución generalizada de vello corporal.
Se confirmó hemianopsia bitemporal mediante campo visual computarizado (CVC) y panhipopituitarismo bioquímico: cortisol sérico 1.2 μg/dl (3.7-19), ACTH < 5 pg/ml (4.7-48), LH 0.2 mUI/ml (1.5-9.3), testosterona total < 0.1 ng/ml (2.4-8.2), TSH 4.04 mUI/ml (0.25-4.5), T4 5.2 μg/dl (5.1-14.1), IGF-1 39.7 ng/ml (81-230), PRL 15.2 ng/ml (2.1-17.7)
Se inició sustitución con hidrocortisona 20 mg/día, levotiroxina 75 μg/día y testosterona gel 1% 5 g/día.
La resonancia magnética (RM) mostró lesión expansiva selar de señal heterogénea de 53 × 32 × 32 mm (CCxTxAP), isointensa en ponderaciones T1 y T2 con intenso realce post-contraste, que producía efecto de masa sobre estructuras supraselares; especialmente quiasma óptico. Englobaba parcialmente las estructuras de ambos senos cavernosos, sin alterar el calibre y vacío de flujo de arterias carótidas (Fig. 1A).
Con diagnóstico presuntivo de macroadenoma hipofisario no funcionante (MANF) por compromiso visual, se indicó tratamiento quirúrgico. Se realizó resección amplia por vía endoscópica transesfenoidal con requerimiento transfusional y soporte hemodinámico con drogas vasoactivas debido a sangrado intraquirúrgico profuso.
El análisis histopatológico informó proliferación de células fusiformes de núcleos alargados y citoplasma eosinófilo, dispuestas en patrón sólido arremolinado, con aislados depósitos de hemosiderina. La tinción inmunohistoquímica (IHQ): vimentina, proteína S100 y TTF-1 positiva y negativa para sinaptofisina, proteína ácida gliofibrilar (GFAP), citoqueratina, desmina, anti-melanoma (HMB45) y actina músculo-específica (HHF35), índice de proliferación Ki 67 3%. El diagnóstico anatomopatológico fue compatible con oncocitoma fusocelular (Fig. 2).
El paciente evolucionó con mejoría visual postquirúrgica.
En RM selar, 5 meses posterior a la cirugía, se observó formación sólida heterogénea de límites mal definidos y refuerzo irregular con contraste, interpretada como remanente tumoral. Se decidió realizar radiocirugía hipofraccionada con
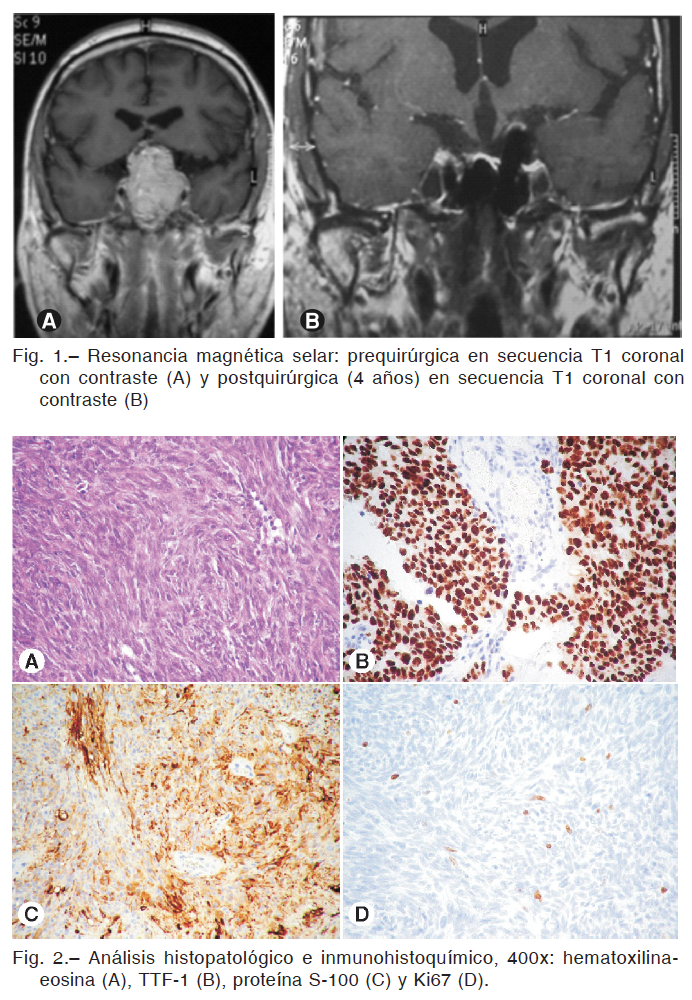
dosis total de 25 Gy; con disminución progresiva de la lesión. En la última RM, realizada a los 4 años de seguimiento, no se observó remanente ni recidiva (Fig. 1B).
Continúa con tratamiento de reemplazo hormonal.
Discusión
El OFC es una neoplasia pituitaria primaria no endocrina infrecuente de linaje celular incierto. Inicialmente se hipotetizó su origen a partir de CFE adenohipofisarias, consideradas células madre adultas7, 8, 10, 11.
En 2013, Mete y col.9 plantearon un origen alternativo debido a la expresión en células neoplásicas de TTF-1, ausente en CFE pero presente en pituicitos normales (células de sostén neurohipofisarias) y en tumores como el pituicitoma y el tumor de células granulares, derivados de pituicitos claros y granulares respectivamente. El subtipo oncocítico de pituicitos se postula como linaje originario del OFC.
Finalmente, como teoría unificadora, se planteó la capacidad celular de expresar TTF-1 según localización: las CFE podrían derivar de la misma región cerebral fetal TTF-1 positiva (origen de los pituicitos) y al migrar a la región selar, interrumpir dicha expresión10. De esta manera, se postula a las CFE como elementos dinámicos, sin estirpe originaria clara.
La observación al microscopio óptico denota fascículos entrelazados de células fusiformes con amplio citoplasma eosinófilo granular (atribuible a la presencia de abundantes mitocondrias) intercaladas con células epitelioides e infiltrado inflamatorio mononuclear. Puede hallarse atipia nuclear y excepcionalmente figuras mitóticas4, 12. No suelen observarse áreas necróticas y el índice de proliferación suele ser bajo, < 5%1, 4. Nuestro caso presentó morfología típica y Ki-67 de 3%.
Las CFE y del OFC, presentan IHQ positiva para proteína S-100, vimentina, TTF-1, antígeno epitelial de membrana (EMA), galectina-3, proteína Bcl-2 (linfoma de células B-2)10, AMA (anticuerpo antimitocondrial 113-1) de tipo granular y, ocasionalmente, GFAP y negativa para hormonas adenohipofisarias, neuromarcadores (cromogranina y sinaptofisina) y citoqueratinas1, 4, 7, 13. Hallamos en el material remitido inmunopositividad para vimentina, proteína S-100 y TTF-1.
Con microscopía electrónica se describen numerosas mitocondrias alargadas y ausencia de gránulos de secreción1, 4. El aumento del número de mitocondrias, denominado cambio oncocítico, se cree debido al fenómeno compensatorio por desacople del metabolismo oxidativo, secundario a mutación del ADN mitocondrial. Se observa con mayor frecuencia en neoplasias renal, tiroidea y glandular salival, aunque puede ocurrir potencialmente en todas las neoplasias1, 11.
Los pacientes consultan mayoritariamente por alteraciones campimétricas, sumado en ocasiones a cefalea, signosintomatología de hipopituitarismo y alteraciones mnésicas1, 10, 11, 14. No suele cursar con diabetes insípida14. Nuestro paciente presentó alteración visual y signos de hipopituitarismo con mejoría de la primera y persistencia de los últimos en la evolución.
En las imágenes (tomografía o RM) la lesión se ubica en topografía selar con extensión supraselar, sin identificación de tejido hipofisario normal1, 11, 14. En secuencia T1 de RM se observa como imagen hipo-iso-intensa con realce temprano heterogéneo con gadolinio14, 15. En T2 puede presentarse iso-hiperintensa15. Recientemente, Hasiloglu y col. informaron características imagenológicas que permitirían la identificación prequirúrgica: puntillado hipointenso milimétrico y áreas lineales con señal ausente en T1 y T2 (correspondiente a depósitos de hemosiderina y vascularización, respectivamente), con realce de las últimas tras la administración de contraste15. La angiorresonancia3 muestra abundantes estructuras vasculares, lo que justifica el profuso sangrado intraquirúrgico observado en numerosos casos3, 14. El alto grado de vascularización explicaría el alto contenido de hemosiderina al microscopio óptico y el aspecto “floreado” en la RM con contraste12. Nuestro paciente presentó una lesión con características habituales en RM y por su alto nivel de vascularización se produjo el sangrado intraquirúrgico.
En el diagnóstico diferencial deben considerarse los MANF (gonadotropos, null cell o corticotropos silentes), y con menor frecuencia meningioma oncocítico, pituicitoma y tumor de células granulares. Schwannoma selar, paraganglioma selar, tumor oncocítico derivado de remanente glandular salival y metástasis de tumores oncocíticos extrahipofisarios son otros posibles diagnósticos diferenciales1, 4, 7, 11, 15.
Los MANF son las lesiones selares más frecuentes y pueden presentar alta densidad mitocondrial, es decir, cambios oncocíticos. Presentan en RM realce post-contraste más lento y persistente que la glándula normal15. Son fácilmente diferenciados por inmunotinción: positiva para hormonas hipofisarias, citoqueratinas y neuromarcadores y negativa para proteína S-100, vimentina y EMA.
El meningioma oncocítico es una variante agresiva infrecuente; suele encontrarse en la convexidad cerebral, aunque otra ubicación posible es la selar. Se diferencia por signos radiológicos: cola dural, hiperostosis adyacente y realce homogéneo con el contraste15. Expresa EMA, vimentina, CD34, Bcl-2, citoqueratina, ACE (antígeno carcinoembrionario) y, raramente, proteína S100.
El pituicitoma es una neoplasia glial de bajo grado, de origen infundíbulo-neurohipofisario compuesto por células ahusadas o epitelioides con presencia de gránulos neurosecretores y baja densidad mitocondrial. Presenta tinción positiva para proteína S100, vimentina, TTF-1 y GFAP, negatividad para EMA4, 6, 15.
El tumor de células granulares suele comprometer neurohipófisis, con extensión supraselar, y está compuesto por células poligonales con citoplasma eosinófilo, PAS positivo7. Presenta vacuolas autofágicas CD-68 positivas (marcador lisosomal), vimentina y GFAP positivo, S-100 y EMA negativo y sin densidad mitocondrial aumentada.
La cirugía es el tratamiento indicado, siempre considerando la probabilidad de sangrado intraquirúrgico debido a la intensa vascularización3, 8, 14, 15. Las recidivas se relacionan con resección quirúrgica incompleta, ya que las características histológicas no varían en las reintervenciones. Los índices de proliferación no correlacionan de manera lineal con el comportamiento tumoral4.
En las recidivas o remanentes tumorales se indica radiocirugía/radioterapia estereotáxica aunque, debido a la baja frecuencia de utilización en la práctica, se desconoce la sensibilidad tumoral a dicho tratamiento5, 14, 15. Nuestro caso aporta evidencia a favor de respuesta tumoral al tratamiento radiante.
Concluimos que, debido a la baja frecuencia de esta patología y su similitud morfológica con los MANF, la consideración del OFC dentro de los diagnósticos diferenciales, llevaría a un abordaje quirúrgico más cuidadoso, con el objetivo de evitar las complicaciones intraquirúrgicas y lograr la resección más completa posible.
La comunicación de nuevos casos de esta entidad permitirá aumentar la evidencia disponible y establecer de manera más contundente la eficacia de los tratamientos disponibles y el pronóstico de esta patología.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Roncaroli F, Scheithauer BW, Cenacchi G, et al. Spindle cell oncocytoma of the adenohypophysis: a tumor of foliculostellate cells? Am J Surg Pathol 2002; 26: 11048-55.
2. Louis DN, Ohgaki H, Wiestler OD, et al. The 2007 WHO classification of tumours of the central nervous system. Acta Neuropathol 2007; 114: 97-109.
3. Fujisawa H, Tohma Y, Muramatsu N, Kida S, Kaizaki Y, Tamamura H. Spindle cell oncocytoma of the adenohypophysis with marked hypervascularity –Case Report–. Neurol Med Chir (Tokyo) 2012; 52: 594-8.
4. Aranda FI, Toro PA, González MJ, Niveiro M. Oncocitoma fusocelular hipofisario: presentación de 2 casos. Rev Esp Patol 2013; 46: 206-11.
5. Ogiwara H, Dubner S, Shafizadeh S, Raizer J, Chandler J. Spindle cell oncocytoma of the pituitary and pituicytoma: two tumors mimicking pituitary adenoma. Surg Neurol Int 2011; 2: 116-20.
6. Mlika M, Azouz H, Chelly I, et al. Spindle cell oncocytoma of the adenohypophysis in a woman: a case report and review of literature. J Med Case Rep 2011; 5: 64-7.
7. Matyja E, Maksymowicz M, Grajkowska W, Olszewski W, Zielinski G, Bonicki W. Spindle cell oncocytoma of the adenohypophysis- a clinicopathological and ultrastructural study of two cases. Folia Neuropathol 2010; 48: 175-84.
8. Coire CI, Horvath E, Smyth HS, Kovacs K. Rapid recurring folliculostellate cell tumor of the adenohypophysis with morphology of a spindle cell oncocytoma: case report with electron microscopic studies. Clinical Neuropathology 2009; 28: 303-8.
9. Mete O, Lopes MB, Asa SL. Spindle cell oncocytomas and granular cell tumors of the pituitary are variants of pituicitoma. Am J Surg Pathol 2013; 37: 1694-9
10. Vajtai I, Sahli R, Kappeler A. Spindle cell oncocytoma of the adenohypophysis: report of a case with a 16-year follow-up. Pathology 2006; 202: 745-50.
11. Romero-Rojas AE, Melo-Uribe MA, Barajas-Solano PA, Chinchilla-Olaya SI, Restrepo Escobar LI, Hernandez-Walteros DM. Spindle cell oncocytoma of the adenohypophysis. Brain Tumor Pathol 2011; 28: 359-64.
12. Borges MT, Lillehei KO, Kleinschmidt-DeMasters BK. Spindle cell oncocytoma with late recurrence and unique neuroimaging characteristics due to recurrent subclinical intratumoral bleeding. J Neurooncol 2011; 101: 145-54.
13. Vajtai I, Beck J, Kappeler A, Hewer E. Spindle cell oncocytoma of the pituitary gland with follicle-like component: Organotypic differentiation to support its origin from folliculostellate cells. Acta Neuropatol 2011; 122: 253-8.
14. Covington MF, Chin SS, Osborn AG. Pituicytoma, spindle cell oncocytoma and granullar cell tumor: clarification and meta-analysis of the world literature since 1983. Am J Neuroradiol 2011; 32: 2067-72.
15. Hasiloglu ZI, Ure E, Comunoglu N, et al. New radiological clues in the diagnosis of spindle cell oncocytoma of the adenohypophysis. Clinical Radiology 2016; 71: 937.e5-e11
– – – –
[…] En términos latos, lo que debemos desear al escribir es ser claros, precisos y concisos*. No olvide el lector estas tres condiciones. A esas tres condiciones debemos sacrificarlo todo, absolutamente todo. Esas tres condiciones son la vida, y ante la vida no hay nada que pueda oponerse: ni condiciones gramaticales, ni purismos, ni cánones estéticos. Cada cosa en el lenguaje escrito debe ser nombrada con un nombre propio; los rodeos, las perífrasis, los circunloquios embarazarán y recargarán y ofuscarán el estilo. Pero para nombrar cada cosa con su nombre…debemos saber el nombre de las cosas. […]
Azorín (José Martínez Ruiz) (1873-1967)
La palabra y la vida. Clásicos y modernos. Sexta edición. Buenos Aires: Losada, 1961, p 125
*Bastardilla en el original.
