J. Dubochet (Universidad de Lausana, Suiza), J.Frank (Universidad de Columbia, EE.UU.) y R. Henderson (Cambridge, Gran Bretaña) fueron distinguidos con el premio Nobel de Química 2017 por el desarrollo de la criomicroscopía electrónica, una herramienta para la determinación estructural en alta resolución de biomoléculas, un adelanto que se suma a la difracción de rayos X y tiene la ventaja de que al congelar la muestra con nitrógeno líquido –visualizada por medio de microscopia electrónica de transmisión– la misma conserva su forma natural, sin la dificultad de obtener cristales de las proteínas de membrana embebidas en lípidos. El primer trabajo se publicó en 1981 y el número de ellos fue creciendo al mismo tiempo que sus aplicaciones. Nos referiremos a una de ellas.
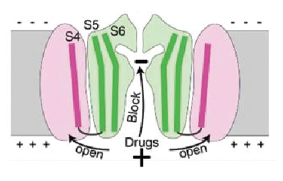
El hERG (human ether-a-go-go-related gene) es un canal de K+ que interviene en la repolarización del potencial de acción cardíaco; su mal funcionamiento o ausencia es responsable de una forma del síndrome de QT prolongado. Lo forman cuatro subunidades dispuestas alrededor del poro con 6 segmentos transmembrana cada una (Figura). Su funcionamiento es complejo, inverso al de otros canales potásicos, con una activación lenta de varios mseg, pero a medida que el potencial se negativiza la inactivación se recupera y los canales se abren en forma rápida generando una corriente saliente de K+, repolarizante del potencial de acción que ocurre durante el intervalo QT del ECG. Esta repolarización es vital por su papel protector al evitar la generación de descargas prematuras que llevarían a una arritmia grave. Una particularidad del hERG es su bloqueo por varios tipos de drogas que incluyen antibióticos (grepafloxacina), antipalúdicos (quinina), antihistamínicos (astemizol) anti arrítmicos (quinidina), gastrocinéticos (cisapride) y antipsicóticos (sertindole). ¿Cómo es posible que drogas tan diferentes bloqueen un mismo canal? Hasta hace poco tiempo era una pregunta sin respuesta, un misterio biofísico. Este año, Wang y MacKinnon –este último ganador del premio Nobel de Química 2003– parecen haber dado en el clavo utilizando la criomicroscopía electrónica, la herramienta inventada por el reciente trío galardonado. Descubrieron que los extremos carboxilos negativos de la proteína del canal enfrentan a la cavidad central del poro iónico que es muy pequeña, de unos pocos ε, y en ese pequeño espacio y por la mayor constante dieléctrica del agua sobre el de la proteína constitutiva del canal, predomina un potencial electrostático negativo. Ahora bien, el potencial de una esfera conductora (ley de Gauss) es = Q/4*Π*ε*R, donde Q es la carga, ε es una constante y R el radio de la esfera, así que es sencillo entender con esta ecuación estudiada en el colegio secundario que el potencial electrostático es cada vez más negativo con menores radios, en este caso el de la cavidad central. Esta carga –εÚρεκα– es la que atrae a una serie de moléculas distintas que tienen en común una carga positiva y que al bloquear el HERG pueden llevar a la muerte súbita. ¿No es esto una aplicación extraordinaria que apoya la decisión del Comité del premio Nobel?
Dubochet J. Cryo-EM–the first thirty years. J Microsc 2012; 245:221-4. Kotsias BA. Funciones de los canales iónicos. En: La miastenia gravis y problemas relacionados. C. Mazia ed., Buenos Aires: Inter-Médica, 2017. Wang W, MacKinnon R. Cryo-EM structure of the Open Human Ether-à-go-go-Related K+ Channel hERG. Cell 2017; 169: 422-30.
Comentarios a Basilio A. Kotsias, kotsias@retina.ar
