ANA L. FELIPOFF1, 2, SILVANA J. FLEISCHMAN1, 2, M. LUJÁN DONADÍO1, 3, VANESA SEBASTIANO1, 3,
MARCELO CASTRO1, 4, ALEJANDRA VELLICCE1, 4, JORGE A. REY1, 4, MARTA M. LARDO1, 5, SILVIA H. LANGINI1, 2
1, 2Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Cátedra de Nutrición. Buenos Aires, Argentina.
1,3Universidad de Buenos Aires. Facultad de Medicina. Escuela de Nutrición. Buenos Aires, Argentina.
1,4Universidad de Buenos Aires. Hospital de Clínicas José de San Martín. Departamento de Hemoterapia,
Buenos Aires, Argentina.
1,5Universidad de Buenos Aires. Facultad de Farmacia y Bioquímica. Departamento de Bioquímica Clínica.
Laboratorio de Hematología. Buenos Aires, Argentina
Resumen El consumo excesivo de hierro (Fe) en portadores de mutaciones en el gen HFE puede resultar en
sobrecarga. Para evaluar el riesgo de sobrecarga de Fe fueron investigados 166 varones adultos donantes de sangre de la ciudad de Buenos Aires. Se estimó la ingesta diaria de Fe (IFe), de Fe hemínico y de Fe proveniente de harinas enriquecidas con SO4Fe. Se determinó ferritina sérica y porcentaje de saturación de transferrina (criterio de sobrecarga de Fe: ferritina sérica > 300 ng/ml y saturación de transferrina ≥ 50%). Las mutaciones C282Y, H63D y S65C fueron investigadas en sangre mediante PCR-RFLP. Todos los participantes cubrieron ampliamente el requerimiento estimado promedio de Fe (6 mg Fe/día) y 3.0% superó el máximo tolerable (45 mg Fe/día). El Fe hemínico correspondió al 9.4% de la IFe y el de harinas enriquecidas al 47.7%. Se observó una asociación entre el aumento de IFe y el de ferritina sérica (p = 0.0472), y el 2.3% de los donantes presentaron ferritina sérica > 300 ng/ml y saturación de transferrina ≥ 50%. El 29.3% de los donantes eran portadores de los genotipos H63D, S65C o C282Y, asociados a hemocromatosis hereditaria, y tenían valores de saturación de transferrina significativamente mayores a los de los donantes wild type (p = 0.0167). Si bien la incidencia clínica de hemocromatosis hereditaria fue baja en el grupo estudiado (1.2%), el consumo excesivo de Fe plantea un riesgo potencial para la salud de individuos que ignoran sus antecedentes familiares de sobrecarga de Fe.
Palabras clave: ingesta de hierro, ferritina sérica, saturación de transferrina, gen HFE, hemocromatosis here-
ditaria, fortificación de alimentos
Abstract Iron intake and HFE gen in male adults from Buenos Aires. Excess iron (Fe) intake in subjects
carrying certain mutations in the HFE gene may result in Fe overload. To estimate risk of Fe overload, 166 male blood donors (19-65 years) from Buenos Aires city were investigated. Daily Fe intake (FeI), hem Fe intake, and Fe intake from SO4Fe enriched flours were estimated (SARA Computer Program and Food Composition Table, USDA). Serum ferritin and transferrin saturation were determined; criteria for Fe overload was serum ferritin > 300 ng/ml and transferrin saturation ≥ 50%. HFE genotypes C282Y, H63D and S65C were analyzed by PCR-RFLP in blood samples. No participant presented FeI lower than the estimated average requirement (6 mg Fe/day) and 3.0% was over the upper level (45 mg Fe/day). Hem Fe and Fe from flour enrichment were 9.4% and 47.7% of daily Fe intake, respectively. A significant association was observed between the increase in serum ferritin (ng/ml) and the increase in FeI (p = 0.0472); 2.3% of the donors presented serum ferritin > 300 ng/ml and transferrin saturation ≥ 50%. Genotypes associated with hereditary hemochromatosis (H63D, S65C and C282Y) were found in 29.3% of the donors. The percentage of transferrin saturation was higher in subjects carrying mutation than in wild type subjects (p = 0.0167). Although penetrance of hereditary hemochromatosis in the studied group was only 1.2%, an excessive Fe intake could enhance adverse effects in individuals unaware of any family history of Fe overload.
Key words: iron intake, serum
Recibido: 27-XII-2016 Aceptado: 3-VIII-2017
Dirección postal Dra. Silvia H. Langini, Cátedra de Nutrición, Facultad de Farmacia y Bioquímica, Universidad de Buenos Aires, Junín 956 2do piso, 1113 Buenos Aires, Argentina
e-mail: slangini@ffyb.uba.ar
La alimentación (producción, selección, preparación, conservación, combinación y consumo de alimentos) es un hecho de profundo arraigo cultural que ha ido modelando las sociedades a través de la historia1. En Argentina, la canasta familiar básica está constituida por una gran variedad de alimentos, entre los cuales las carnes constituyen uno de los prioritarios. En 2011, la disponibilidad de carnes fue de 105.3 kg/año/hab, de los cuales 54.9 provenían de carne vacuna2. Esto resulta en un elevado porcentaje de Fe hemínico de alta biodisponibilidad en la dieta, con efecto facilitador sobre la absorción del Fe no hemínico (de baja biodisponibilidad) aportado por cereales, alimentos vegetales, carnes y alimentos fortificados3.
No obstante, en agosto de 2002 se promulgó la Ley N° 256304 que establece normas para la prevención de las anemias y las malformaciones del tubo neural. Para ello, la harina de trigo que se comercializa en el mercado nacional destinada al consumo se adiciona con Fe (30 mg Fe/kg) en forma de sulfato ferroso, además de ácido fólico, tiamina, riboflavina y niacina. El enriquecimiento de la harina de trigo con Fe es una estrategia a largo plazo utilizada en diversos países para reducir la prevalencia de su deficiencia5, que continúa afectando a millones de personas en todo el mundo6. Sin embargo, por sus características, esta práctica alcanza no solo a los grupos de riesgo sino que el aumento en el consumo de Fe de ella derivado recae sobre toda la población, aun aquella que por sus hábitos alimentarios no presenta riesgo de sufrir deficiencia.
La hemocromatosis hereditaria representa un riesgo para la salud y se caracteriza por una elevada absorción del Fe aportado por la dieta7, 8. En individuos normales el Fe hemínico es más eficientemente absorbido que el Fe inorgánico de la dieta. En cambio, en individuos portadores de mutaciones asociadas a hemocromatosis hereditaria la absorción del Fe, tanto hemínico como no hemínico, es mucho mayor9-11.
El primer gen que se encontró asociado a hemocromatosis hereditaria fue HFE12. En la actualidad, se distinguen diferentes tipos genéticos de la enfermedad. Estos también pueden deberse a mutaciones de los genes que codifican la síntesis de otras proteínas involucradas en el mantenimiento de la homeostasis del Fe, como hepcidina, ferroportina, hemojuvelina y receptor 2 de la transferrina13-16. Entre las mutaciones del gen HFE claramente asociadas a hemocromatosis hereditaria tipo I, el genotipo C282Y homocigota se encuentra en 67-95% de los casos diagnosticados clínicamente17. Otras mutaciones del gen HFE, como H63D y S65C, son consideradas variantes genéticas que incrementan el riesgo de desarrollar formas leves de hemocromatosis hereditaria18.
Todos los tipos de hemocromatosis hereditaria comparten características clínicas y biológicas, incluida la elevación de la saturación de transferrina y de la ferritina sérica19, con una frecuencia cinco veces mayor en varones que en mujeres18.
El grado de acumulación de Fe en individuos homocigotas para la hemocromatosis hereditaria depende tanto de los hábitos dietarios a lo largo de la vida como de las políticas de fortificación con Fe a nivel nacional9. El porcentaje de individuos que desarrollará síntomas clínicos es aún incierto, y la gravedad de la enfermedad varía ampliamente con eventual evolución hacia diversas afecciones, como cirrosis y cáncer hepático, entre otras20.
En Argentina se ignora la prevalencia de la hemocromatosis hereditaria en la población general, y más aún, la influencia que puedan ejercer diversos factores externos, entre ellos la alimentación.
La Encuesta Nacional de Nutrición y Salud (ENNyS)21, único estudio a nivel nacional disponible sobre la situación alimentario-nutricional, evaluó solo la situación de la población materno-infantil pero no incluyó el grupo de varones adultos.
El objetivo de este trabajo fue estudiar el riesgo por sobrenutrición con Fe en varones adultos clínicamente sanos donantes de sangre en un hospital público de Ciudad Autónoma de Buenos Aires. Para ello, se evaluó la ingesta de Fe habitual, junto con marcadores bioquímicos y moleculares asociados a hemocromatosis hereditaria.
Materiales y métodos
Se enrolaron 166 varones (19-65 años) donantes de sangre voluntarios concurrentes al Departamento de Hemoterapia del Hospital de Clínicas José de San Martín de la Universidad de Buenos Aires, período abril 2012 – septiembre 2014, aceptados según las Normas Técnicas y Administrativas de Hemoterapia22. Los donantes firmaron un consentimiento informado. El registro cuantitativo de la ingesta de Fe se realizó mediante un cuestionario de “Frecuencia de Consumo de Alimentos”23 que incluyó entre otros: carnes y derivados, cereales y panificados elaborados con harina enriquecida (30 mg Fe/kg, Ley 25630/2002), legumbres, lácteos, vegetales y frutas. Adicionalmente, se interrogó al donante acerca del consumo de suplementos dietarios y su origen familiar. La ingesta diaria de Fe (IFe), de Fe hemínico (IFe hem), de Fe no hemínico total (IFe no hem), y de Fe no hem proveniente de las harinas enriquecidas con SO4Fe se cuantificó utilizando el Programa Informático SARA (Sistema de Análisis y Registro de Alimentos, Ministerio de Salud) y la Tabla de Composición de Alimentos del USDA (USA). Se descartó 17.5% (29/166) de las muestras de sangre por presentar serología de rutina del Banco de Sangre y/o Proteína C Reactiva (Wiener, lab) positivas. El porcentaje de saturación de transferrina (%ST) y la ferritina sérica (FS) fueron medidos simultáneamente en 132 muestras de suero. En 5 donantes, la recolección de un volumen insuficiente de suero, permitió solo la determinación de uno de los dos indicadores. Las muestras de sangre fueron centrifugadas, y los sueros separados y conservados convenientemente a -20 °C hasta su análisis. El %ST se midió a partir del Fe sérico (Fes) (IRON2 Cobas) y de la capacidad total de fijación de Fe (TIBC) (Tina-quant Transferrin, Cobas); la ferritina sérica (FS) fue determinada por IMMULITE Ferritin, DPC. Para este estudio se definió posible riesgo de sobrecarga de Fe cuando FS fue > 300 ng/ml24, 25 y ST ≥ 50%26.
La presencia de las mutaciones para hemocromatosis tipo I: C282Y, H63D y S65C (PCR- RFLP) se estudió solo en los primeros 99 donantes debido al elevado costo de procesamiento de cada muestra. Se utilizó sangre entera recogida con EDTA o sobre papel de filtro.
El análisis estadístico de los datos se realizó utilizando el programa GraphPad Instat® Version 3.05. Para la comparación de medias se utilizó el test de t de dos colas para muestras no pareadas (Mann-Whitney Test), no paramétrico. Los aspectos éticos fueron observados según las normativas fijadas por organismos nacionales e internacionales. El estudio cuenta con aprobación del Comité de Ética del Hospital de Clínicas José de San Martín de la Universidad de Buenos Aires.
Resultados
La edad fue mayor de 40 años en 34% (56/166) de los participantes. El 57% (95/166) informó pertenecer a una familia de origen europeo.
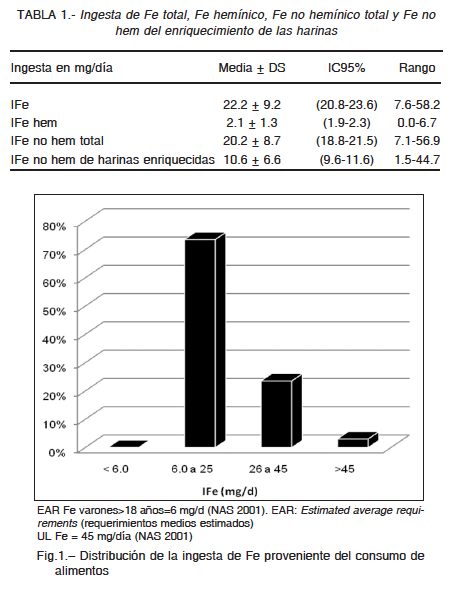
Las ingestas diarias de Fe, de Fe hemínico, de Fe no hemínico total y de Fe no hem de enriquecimiento de las harinas se indican en la Tabla 1. El Fe hem representó el 9.4% de la IFe, y el Fe no hem proveniente de enriquecimiento de las harinas alcanzó el 47.7% de la IFe, o el 52.5% en relación a la IFe no hem total.
La Fig. 1 muestra la distribución del grupo de participantes según rangos de IFe proveniente de los alimentos consumidos. El consumo de suplementos dietarios fue informado por 5.4% (9/166) de los participantes, de los cuales 3.6% (6/166) consumían algún suplemento dietario que incluía Fe en su formulación.
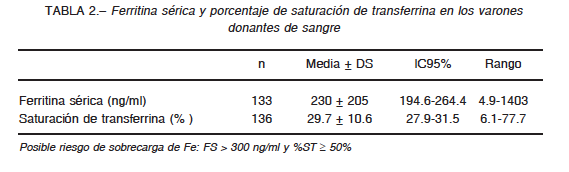
Los valores de FS (ng/ml) y %ST se indican en la Tabla 2. Se observó un aumento significativo de los valores de FS (ng/ml) con el incremento en la IFe (mg/día): y = 3.8832x + 145.72; r = 0.173 (p = 0.0472); IC95%: 0.002239 – 0.3353. Sin embargo, la relación no fue significativa entre el %ST y la IFe: y = 0.1261x + 26.975; r = 0.11 (p = 0.2097); IC95%: -0.06172-0.2736.
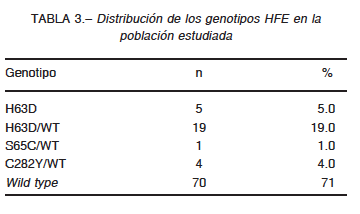
Los genotipos H63D, S65C y C282Y (asociados a hemocromatosis hereditaria) se encontraron en 29.3% (29/99) de los participantes. La distribución de los diferentes genotipos se muestra en la Tabla 3.
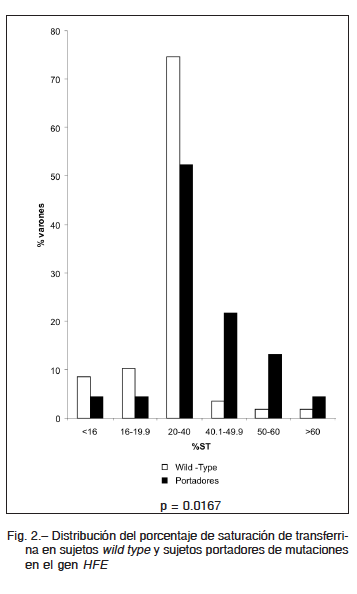
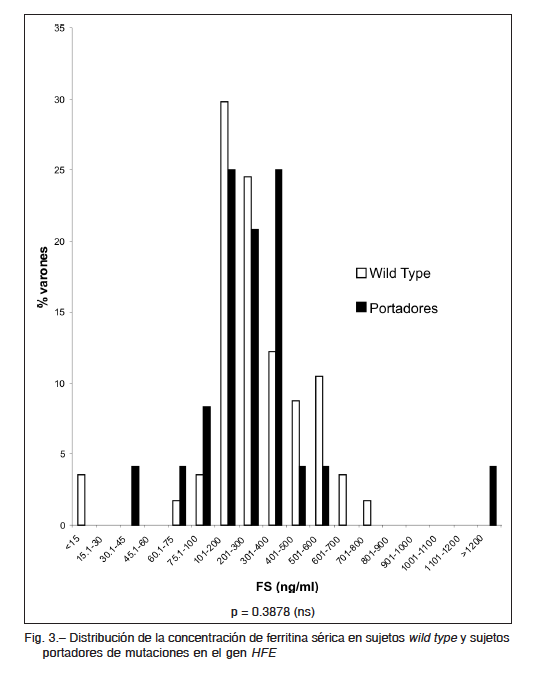
Los valores medios de %ST fueron estadísticamente mayores en los portadores de alguna de las mutaciones del gen HFE (C282Y, H63D y S65C) respecto de los sujetos wild type (36.6 ± 14.5 vs. 28.6 ± 10.2, p = 0.0167). En cambio, los niveles de FS no fueron estadísticamente diferentes entre ambos grupos (277 ng/ml ± 272 vs. 281 ±
170, p = 0.3878). La distribución por rangos de ambos indicadores se muestra en Fig. 2 y Fig. 3, respectivamente.
Es importante destacar que tres de los 132 donantes (2.3%) a los que se les determinó FS y %ST presentaban valores compatibles con posible sobrecarga de Fe. Por otra parte, dos de los 166 donantes (1.2%) se encontraban con tratamiento clínico por diagnóstico de hemocromatosis hereditaria. Sin embargo, el resto de los donantes no manifestó conocimiento de padecer alteraciones en el metabolismo del Fe (Tabla 4).
Discusión
La información obtenida en este trabajo constituye un aporte al conocimiento de la ingesta habitual de Fe de varones adultos, grupo poblacional que no fue incluido en la única encuesta nutricional realizada a nivel nacional en nuestro país (ENNyS, 2007)21.
En todos los participantes de este estudio las ingestas de Fe fueron sensiblemente mayores que el requerimiento estimado promedio para el varón adulto (6 mg Fe/d)27. Más aun, la ingesta de Fe proveniente exclusivamente de los alimentos fue mayor a 45 mg Fe/día (nivel máximo tolerable)27 en el 3.0% de los participantes. Es importante destacar que más de la mitad de la ingesta de hierro no hemínico provenía del enriquecimiento de las harinas (Tabla 1). La información obtenida acerca del consumo de suplementos dietarios advierte sobre el riesgo de ingestas de Fe aún superiores.
En la población general, es poco probable que el consumo prolongado de dietas ricas en Fe resulte en sobrecarga de Fe. Sin embargo, la hemocromatosis hereditaria es una patología de acumulación de Fe, y por lo tanto guarda relación con la edad. La correlación significativa hallada entre ferritina sérica e ingesta de Fe (p = 0.0472) alerta sobre una posible acumulación progresiva de Fe, que generalmente se manifiesta clínicamente a partir de la cuarta década de la vida28. En este sentido, se corroboró que tanto los sujetos con posible riesgo de exceso de Fe como aquellos con tratamiento clínico por hemocromatosis hereditaria eran mayores de 40 años (Tabla 4).
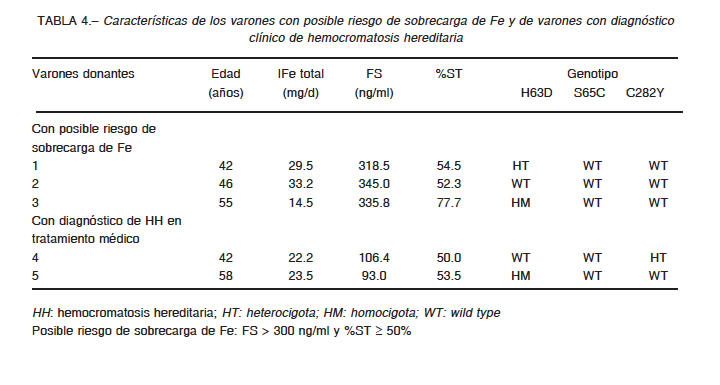
El hallazgo de un donante sin presencia de las mutaciones estudiadas y con valores elevados de FS y %ST, sugiere la presencia de otras causas genéticas de hemocromatosis. Mutaciones en otros genes asociados al metabolismo del Fe, como hepcidina, ferroportina, hemojuvelina, receptor 2 de la transferrina29, no estudiados en este trabajo, podrían estar presentes en este individuo.
Otro aspecto a tener en cuenta es el origen familiar, que podría sumarse al riesgo de padecer esta patología. El 57% de los varones provenía de familia de origen europeo, entre ellos uno de los sujetos con posible criterio de sobrecarga de Fe y los dos casos con diagnóstico clínico de hemocromatosis hereditaria. Si bien la población de la Ciudad de Buenos Aires se caracteriza por presentar un marcado componente europeo, está bastante mestizada y se cuestiona el concepto de “crisol de razas”30. Los datos de bibliografía sugieren que la mutación C282Y es de origen celta31 o escandinavo32, 33. El origen de la mutación H63D es menos conocido y la mayor frecuencia fue detectada en la Península Ibérica, países que rodean el Mar Mediterráneo, y Medio Oriente hasta India33.
De acuerdo con datos en bibliografía, menos del 1% de los individuos homocigotas desarrollan la forma clínica de la hemocromatosis hereditaria34, porcentaje similar (1.2%) al encontrado en este estudio. Sin embargo, en el caso particular de la población argentina, la influencia de factores externos no debería menospreciarse. El hábito de consumir carne en cantidades importantes, la creciente tendencia de la industria alimentaria a fortificar con Fe alimentos de consumo habitual, aun en aquellos no comprendidos en la Ley 25630, y el eventual consumo de suplementos que contienen Fe plantean un potencial riesgo para la salud de una parte de la población clínicamente sana que desconoce antecedentes familiares de sobrecarga de Fe.
Agradecimientos: Trabajo financiado por Universidad de Buenos Aires, UBACyT 20720120200004BA y UBACyT 20720150100004BA.
A la Lic. Romina Airaldi por el análisis de las encuestas nutricionales, y a la Bioquímica Marcela Pandolfo por su colaboración en las determinaciones bioquímicas. Al personal del Departamento de Hemoterapia del Hospital de Clínicas José de San Martín de la Universidad de Buenos Aires por su apoyo técnico.
Conflicto de intereses: Ninguno para declarar
Bibliografía
1. Aguirre P. Del gramillón al aspartamo. Las transiciones alimentarias en el tiempo de la especie. En: Boletín Informativo Techint 2001; 306: 93-120.
2. Organización de las Naciones Unidas para la Agricultura y la Alimentación (FAO). Hoja de Balance de Alimentos, Argentina año 2011. FAOSTAT. En: http://www.fao.org/faostat/en/#data/FBS/report; consultado octubre 2017.
3. Beard J. Iron. In: Bowman BA & Russell RM, eds. Present Knowledge in Nutrition, 9th ed. Washington, DC: International Life Sciences Institute, 2006, p 430-44.
4. Boletín Oficial de la República Argentina, 23 de agosto de 2002. Ley 25630 Prevención de Anemias y Malformaciones del Tubo Neural.
5. Gera T, Sachdev HS, Boy E. Effect of iron-fortified foods on hematologic and biological outcomes: systematic review of randomized controlled trials. Am J Clin Nutr 2012; 96: 309-24.
6. Jacoby E, Tirado C, Díaz A, et al. Una mirada integral a las políticas de agricultura familiar, seguridad alimentaria, nutrición y salud pública en las Américas. Documento de trabajo de FAO, OPS/OMS; CEPAL, IICA y el Alto Comisionado de Naciones Unidas para los Derechos Humanos. Lima, Perú, Mayo 2014. En: http://www.fao.org/americas/noticias/ver/es/c/232244/; consultado julio 2015.
7. Halliday JW. Hemochromatosis and iron needs. Nutr Rev 1998; 56: S30-S37.
8. Ulvik RJ. The liver in haemochromatosis. J Trace Elem Med Biol 2015; 31: 219-24.
9. Tao M, Pelletier DL. The effect of dietary iron intake on the development of iron overload among homozygotes for haemochromatosis. Public Health Nutr 2009; 12: 1823-9.
10. Beutler E. The HFE Cys282Tyr mutation as a necessary but not sufficient cause of clinical hereditary hemochromatosis. Blood 2003; 101: 3347-50.
11. Crawford DH, Powell LW, Halliday JW. Factors influencing disease expression in hemochromatosis. Annu Rev Nutr 1996; 16: 139-60.
12. Feder JN, Gnirke A, Thomas W, et al. A novel MHC class 1-like gene is mutated in patients with hereditary haemochromatosis. Nat Genet 1996; 13: 399-408.
13. Dunn LL, Suryo Rahmanto Y, Richardson DR. Iron uptake and metabolism in the new millennium. Trends Cell Biol 2007; 17: 93-100.
14. Altes Hernández A, Aranalde Fortó J. Papel de la hepcidina en la patogenia de la hemocromatosis. Gastroenterol Hepatol 2009; 32: 622-6.
15. Brissot P, Troadec MB, Bardou-Jacquet E, et al. Current approach to hemochromatosis. Blood Rev 2008; 22: 195-210.
16. Clark P, Britton LJ, Powell LW. The diagnosis and management of hereditary haemochromatosis. Clin Biochem Rev 2010; 31: 3-8.
17. Hanson EH, Imperatore G, Burke W. HFE gene and hereditary hemochromatosis: a HuGE review. Human Genome Epidemiology. Am J Epidemiol 2001; 154: 193-206.
18. Orsilles MA. Hemocromatosis hereditaria: genética y diagnóstico. Acta bioquím clín latinoam 2000; 34: 339-50.
19. Yip R. Hierro. En: Bowman BA, Russell RM, eds. Conocimientos Actuales sobre Nutrición. 8va ed. Washington, DC: OPS e Instituto Internacional de Ciencias de la Vida, 2003, p 340 -59.
20. Casgrain A, Collings R, Harvey LJ, Hooper L, Fairweather-Tait SJ. Effect of iron intake on iron status: a systematic review and meta-analysis of randomized controlled trials. Am J Clin Nutr 2012; 96: 768-80.
21. Ministerio de Salud. Encuesta Nacional de Nutrición y Salud (ENNyS). Documento de resultados 2007. En: http://www.msal.gov.ar/images/stories/bes/graficos/0000000257cnt-a08-ennys-documento-de-resultados-2007.pdf; consultado octubre 2017.
22. Ministerio de Salud y Ambiente de la Nación. Boletín Oficial de la República Argentina Resolución 865. 2006, 30935:16-42. En: http://www.aahi.org.ar/wp-content/uploads/2014/01/Criterios-de-selecci%C3%B3n-2013.pdf; consultado junio 2016.
23. Pao EM y Cypel YS. Cálculo de la ingesta alimentaria. En: Bowman BA, Russell RM, eds. Conocimientos Actuales de Nutrición. 7ma ed. Washington, D.C: OPS e Instituto Internacional de Ciencias de la Vida, 1997, p 531-41.
24. Gibson RS. Assessment of iron status. In: Gibson RS, ed. Principles of Nutritional Assessment. New York: Oxford University Press, 1990, p 349-76.
25. Sauberlich, H. Iron. In: Laboratory Test for the Assessment of Nutritional Status. I. Wolinsky, ed. 2nd ed. Boca Raton, FL: CRC Press, 1999, p 343-61.
26. Adams P, Reboussin D, Leiendecker-Foster C, et al. Comparison of the unsaturated iron-binding capacity with transferrin saturation as a screening test to detect C282Y homozygotes for hemochromatosis in 101,168 participants in the hemochromatosis and iron overload screening (HEIRS) study. Clin Chem 2005; 51: 1048-52.
27. Food and Nutrition Board, The Institute of Medicine. Dietary Reference Intakes for Vitamin A, Vitamin K, Arsenic, Boron, Chromium, Copper, Iodine, Iron, Manganese, Molybdenum, Nickel, Silicon, Vanadium and Zinc. National Academy Press, Washington, D.C., 2001. En: www.nap.edu/read/10026/chapter/1; consultado noviembre 2016.
28. Kohgo Y, Ikuta K, Ohtake T, Torimoto Y, Kato J. Body iron metabolism and pathophysiology of iron overload. Int J Hematol 2008; 88: 7-15.
29. Santos PC, Dinardo CL, Cançado RD, et al. Non-HFE hemochromatosis. Rev Bras Hematol Hemoter 2012; 34: 311-6.
30. Avena SA, Goicoechea AS, Rey J, Dugoujon JM, Dejean CB, Carnese FR. Mezcla génica en una muestra poblacional de la Ciudad de Buenos Aires. Medicina (B Aires) 2006; 66: 113-8.
31. Lucotte G. Celtic origin of the C282Y mutation of hemochromatosis. Blood Cells Mol Dis 1998; 24: 433-8.
32. Milman N, Pedersen P. Evidence that the Cys282Tyr mutation of the HFE gene originated from a population in Southern Scandinavia and spread with the Vikings. Clin Genet 2003; 64: 36-47.
33. Rodriguez LM, Giraldo MC, Velasquez LI, et al. Ancestral association between HLA and HFE H63D and C282Y gene mutations from northwest Colombia. Genet Mol Biol 2015; 38: 8-13.
34. Beutler E, Felitti VJ, Koziol J, Ho NJ, Gelbart T. Penetrance of 845GA (C282Y) HFE hereditary haemochromatosis mutation in the USA. Lancet 2002; 359: 211-8.
– – – –
And yet, we will still need our libraries and archives. John Seely Brown and Paul Duguid have written of the so-called “social life of information”—the form in which you encounter a text can have a huge impact on how you use it. Original documents reward us for taking the trouble to find them by telling us things that no image can. Duguid describes watching a fellow-historian systematically sniff two-hundred-and-fifty-year-old letters in an archive. By detecting the smell of vinegar—which had been sprinkled, in the eighteenth century, on letters from towns struck by cholera, in the hope of disinfecting them—he could trace the history of disease outbreaks. […]
Y todavía necesitamos de nuestras bibliotecas y archivos. John Seely Brown y Paul Duguid han escrito sobre la llamada “vida social de la información”—la forma en la cual usted encuentra un texto puede tener un gran impacto en como lo usa. Los documentos originales nos recompensan del trabajo en hallarlos diciéndonos cosas que ninguna imagen puede. Duguid cuenta que vio a un colega historiador en un archivo olfateando sistemáticamente viejas cartas de doscientos cincuenta años. Detectando el olor a vinagre—el cual se rociaba, en el siglo dieciocho, sobre las cartas de ciudades azotadas por el cólera, con la esperanza de desinfectarlas—el historiador podía trazar la historia de los brotes de la enfermedad. […]
Anthony Grafton
Digitization and its discontents. The New Yorker, November 5, 2007.
En: http://www.newyorker.com/reporting/2007/11/05/071105fa_fact_grafton
